
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的危害,必须进行处理。下面是一种处理方法的工业流程:

其中第①步存在平衡:2CrO42—(黄色)+2H+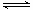 Cr2O72—(橙色)+H2O,下列说法正确的是
Cr2O72—(橙色)+H2O,下列说法正确的是
A.改变反应①的平衡体系中c(H+)浓度,溶液颜色无明显变化
B.若2v (Cr2O72—) =v (CrO42—),说明反应①达平衡状态
C.反应②中还原1mol Cr2O72—,需要6 mol的Fe2+
D.FeSO4溶液呈酸性的原因是Fe2++ 2H2O  Fe(OH) 2↓+ 2H+
Fe(OH) 2↓+ 2H+
科目:高中化学 来源: 题型:
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
根据以上热化学方程式判断,下列说法错误的是
A.CO2气体分解生成CO气和O2气体的反应是放热反应
B.CO气体与O2气体生成CO2气体的反应是放热反应
C.右图可表示由CO气体生成CO2气体的反应过
程和能量关系
D.在相同条件下,2 mol CO气体与1 mol O2气体的能量总和大于2 mol CO2气体的能量

查看答案和解析>>
科目:高中化学 来源: 题型:
将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是 ( )
A.43.2g B.46.8g
C.53.6g D.63.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.l mol•L−1的二元酸H2A溶液中pH=4.0,则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有c(OH-)+c(A2-)=c(H2A)+c(H+)
D.在Na2A溶液中一定有c(Na+)>c(A2-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
用石灰石代替碱液处理酸性废水可降低成本。大多数情况下,利用石灰石处理含金属离子的酸性废水并不适用,原因在于酸与石灰石反应的限度,使溶液体系的pH不能达到6.0以上的排放标准。当酸性废水中含有Fe3+、Fe2+、Al3+时能利用石灰石处理该酸性废水,可使pH上升到6.0以上,达到满意效果,其研究步骤如下:
Ⅰ、向0.1mol/L 盐酸,加入石灰石粉,当溶液体系 pH 升至5.6 时, 再继续加入石灰石粉无气泡冒出,说明此时已达溶解平衡。
Ⅱ、向含Fe3+、Fe2+、Al3+的酸性废水中加入适量的0.1mol/L 盐酸和30% H2O2溶液,充分反应。
Ⅲ、将Ⅱ中获得的溶液加入到Ⅰ溶液中,得到混合液x,测得混合液pH<2.0。
Ⅳ、向混合液x中加入石灰石粉,有大量气体产生,并逐渐有沉淀生成。pH 升到 6.2时停止加石灰石粉。
(1)HCl的电子式是 。
(2)石灰石与盐酸反应的离子方程式是 。
(3)从化学平衡的角度分析CaCO3与盐酸反应的原理 (用化学用语表示)。
(4)CaCl2溶液显中性,步骤Ⅰ中溶液体系 pH = 5.6的原因是 。
(5)步骤Ⅱ中反应的离子方程式是 。
(6)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol/L
根据表中数据解释步骤Ⅱ的目的: 。
(7)步骤Ⅳ中,当 pH 上升到 3.3 以上时,会促进Al3+的水解,Al3+水解的离子方程式是 。
(8)步骤Ⅳ中溶液体系的 pH 可上升到6.2,是因为生成Al(OH)3可与溶液中的HCO3-反应使c(CO32-)增大,该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用一充满氨气的烧瓶做喷泉实验,当水充满整个烧瓶后,烧瓶内的氨水的物质的量浓度是(按标准状况下计算)( )
A.0.045mol·L-1 B.1mol·L-1
C.0.029mol·L-1 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组先将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去。该小组为测定黄钠铁矾的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165 g。
(1)该小组不采用生成Fe(OH)3沉淀的方法除去铁元素,是因为生成的Fe(OH)3 ▲ 。
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为 ▲ ,滴定到终点的颜色变化
为 ▲ 。
(3)通过计算确定黄钠铁矾的化学式(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com