
下列装置或操作正确的且能达到实验目的的是

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
工业上用铝土矿(主要成分是Al2O3、Fe2O3、SiO2)提纯Al2O3做冶炼铝的原料,提取的操作过程可用以下流程图表示:[已知:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓,SiO2能被NaOH溶解]

(1)请写出下列各步反应的化学方程式:
①________,________。 ②________,________。
③________,________。 ④________,________。
(2)若①步没有过滤操作而直接进入步骤②,对后面的操作会有什么影响?
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定体积的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图(Ⅰ)所示,其中t0~t1阶段c(B)未画出。图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中t3~t4阶段为使用催化剂。
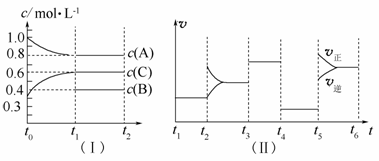
请回答下列问题:
(1)若t1=15 min,则t0~t1阶段以C物质的浓度变化表示反应速率为____________________________。
(2)t4~t5阶段改变的条件为__________,B的起始物质的量浓度为__________。各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
则K1=__________(保留两位小数),K1、K2、K3、K4、K5之间的关系为________________________(用“>”、“<”或“=”连接)。
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式__________________________________。
(4)在相同条件下,若起始时容器中加入a molA、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列几组物质(将正确答案字母填入空中)
A.金刚石和石墨 B.C2H6和C5H12 C.C2H4和C2H6
D.CH3CH2CH2CH3和CH3CH(CH3)2 E.35Cl和37Cl
属于同分异构体的是________;属于同素异形体的是_______;属于同系物的是________;属于同位素的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
“富勒烯”家族又增添了新成员,继C60、C70、N60之后,中美科学家首次发现了全硼富勒烯B40.下列说法正确的是
A. B40、C70都属于新型化合物 B. C60和N60属于同分异构体
C. B40、C60、C70、N60都属于烯烃 D. B40、C60、C70、N60都只含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图所示装置进行下列实验,能得出相应实验结论的是
| 选项 | ① | ② | ③ | 实验结论 |
|
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
无机化合物A中含有元素Li元素,A的摩尔质量23g·mol-1,A主要用于有机合成和药物制造,同时也是良好的储氢材料。在一定条件下,0.1mol固体A与0.1molNH4Cl固体恰好完全反应,生成固体B和4.48L(标准状况)气体C。已知气体C极易溶于水,且得到碱性溶液。电解无水B可生成金属单质D和氯气。请回答下列问题:
(1)A的化学方式是_________________________。
(2)写出化合物A与NH4Cl反应的化学方程式:_______________________________。
(3)某同学通过查阅资料得知物质A的性质:
I.工业上可用金属D与液态的C在硝酸铁催化下反应来制备A物质。
II.物质A遇水强烈水解,释放出气体C。
①I中发生反应的基本反应类型是__________________________。
②物质A遇水强烈水解的化学方程式为_________________________。
(4)工业制备单质D的流程如下:

①步骤①中操作的名称为________________。
②试用平衡原理解释步骤③中减压的目的是:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量可能为9.6g
B.沉淀完全时消耗NaOH溶液体积为150mL
C.参加反应的硝酸的物质的量为0.4mol
D.溶解合金时产生NO气体体积0.224L(以标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下在容积不变的密闭容器中发生如下反应:2SO2+O2 2SO3(g),若开始时只充入2 molSO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为
2SO3(g),若开始时只充入2 molSO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为
A.20% B.40% C.50% D.60%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com