
【题目】处理烟气中的SO2,可以采用碱吸-电解法,其流程如图:模拟过程Ⅱ如图,下列推断正确的是( )
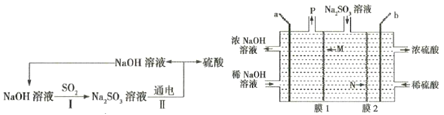
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.SO2是含有极性键的极性分子
C.a极的电极反应式为2H2O-4e-=4H++O2↑
D.若收集22.4 L的P(标准状况下),则有2 mol N离子移向右室
【答案】AB
【解析】
A.b电极上稀硫酸转化为浓硫酸,过程中SO42-的量增大,则是由SO32-转化得到,发生反应SO32--2e-+H2O=SO42-+2H+,则膜2应为阴离子交换膜;a电极上稀NaOH溶液转化为浓NaOH溶液,过程中OH-浓度增大,则发生电极反应2H2O+2e-=2OH-+H2↑,膜1应为阳离子交换膜,A正确;
B.SO2分子中的S=O键是极性共价键,由于分子中正、负电荷重心不重合,因此SO2属于极性分子,B正确;
C.a电极上稀NaOH溶液转化为浓NaOH溶液,过程中OH-浓度增大,且反应有气体产生,则应发生的电极反应式为:2H2O+2e-=2OH-+H2↑,C错误;
D.a电极发生电极反应为:2H2O+2e-=2OH-+H2↑,若收集22.4 LP(标准状况下),即收集标况下H2的的物质的量n(H2)=![]() =1 mol,根据电极反应式可知转移电子数为2 mol,b电极发生反应:SO32--2e-+H2O=SO42-+2H+,根据同一闭合回路中电子转移数目相等,可知有1 mol SO32-通过膜2进入右室,D错误;
=1 mol,根据电极反应式可知转移电子数为2 mol,b电极发生反应:SO32--2e-+H2O=SO42-+2H+,根据同一闭合回路中电子转移数目相等,可知有1 mol SO32-通过膜2进入右室,D错误;
故合理选项是AB。


科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题。
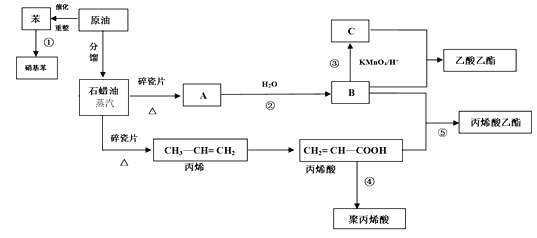
(1)丙烯酸中的官能团的名称为_______。
(2)反应①的化学方程式_______;反应⑤的化学方程式_______。
(3)丙烯酸(CH2 = CH—COOH)可能发生的反应有_______(填序号)
A.加成反应 B.取代反应 C.加聚反应 D.中和反应 E.氧化反应
(4)聚丙烯酸的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。
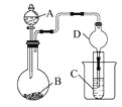
(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图。下列说法错误的是( )

A.干电池是一种将化学能转变为电能的装置
B.原料硫酸可以循环使用,且可用盐酸代替硫酸进行酸溶
C.酸溶时ZnS作还原剂,操作1为过滤
D.通电电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL0.1 mol·L-1一元弱酸HA溶液中滴加0.1 mol·L-1NaOH溶液,溶液中lg![]() 与pH关系如图所示。下列说法正确的是( )
与pH关系如图所示。下列说法正确的是( )
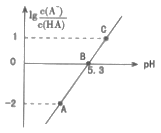
A.25℃时,HA酸的电离常数为1.0×10-5.3
B.A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
C.B点对应的NaOH溶液体积为10 mL
D.对C点溶液加热(不考虑挥发),则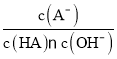 一定减小
一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物应用广泛。
(1)(钛元素基态原子核外最外层电子的自旋状态___(填“相同”或“相反”)。
(2)已知一定条件下TiO2与TiCl4之间可以相互转化:TiO2![]() TiCl4。
TiCl4。
①Ti、Cl、O三种元素电负性由大到小的顺序为___。
②COCl2的分子构型为___,键角大小比较∠Cl—C—O___∠C1—C—Cl(填“>”或“<”),σ键和π键数目之比为___。
③已知室温下TiCl4为无色易溶于乙醇的液体,则TiCl4的晶体类型为___。
(3)配合物[TiCl(H2O)5]Cl2·H2O中,中心离子的配位数是___,向1mol该配合物中加入足量AgNO3溶液,可以得到___molAgCl沉淀。
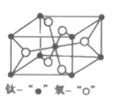
(4)金红石型TiO2的晶胞(α=β=γ=90o)如图所示:TiO2晶体中O原子的配位数是___,其晶胞参数为:a=b=459pm,c=295pm,该晶体密度为___g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+3B(g) ![]() 2C(g),达到平衡的标志是
2C(g),达到平衡的标志是
A.C生成的速率与C分解的速率相等
B.A、B、C的浓度相等
C.单位时间内生成n molA,同时消耗2nmol C
D.单位时间内生成n molA,同时消耗3nmol B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一定浓度的一元酸HA溶液和一定浓度的NaOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度(mol/L) | 反应后溶液的pH | |
|
| ||
① | 0.1 | 0.1 | 9 |
② |
| 0.2 | 7 |
下列判断不正确的是( )
A.实验①反应的溶液中:![]()
B.实验①反应的溶液中:![]()
C.实验②反应的溶液中:![]()
D.实验②反应的溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com