
 ;B的结构简式为
;B的结构简式为 ;与A含有相同种类和数目的官能团(包括苯环)、且苯环上取代基位置和数量也相同的同分异构体有多种,写出其中任意一种的结构简式
;与A含有相同种类和数目的官能团(包括苯环)、且苯环上取代基位置和数量也相同的同分异构体有多种,写出其中任意一种的结构简式 (不包括原化合物,不考虑立体异构).
(不包括原化合物,不考虑立体异构). 分析 芳香族化合物A的分子式为C16H16,若A用KMnO4酸性溶液氧化,则仅得到一种二元酸B,A应为对称结构,不饱和度为$\frac{2×16+2-16}{2}$=9,能使Br2的CCl4溶液和稀冷KMnO4溶液褪色,在温和条件下可以跟H2以1:1催化加成,含有2个苯环、1个碳碳双键,B分子中有两种不同化学环境的氢原子,其原子个数比为1:2,则A中苯环含有甲基,且与碳碳双键处于对位位置,故A的结构简式为: ,B为
,B为 ,据此解答.
,据此解答.
解答 解:芳香族化合物A的分子式为C16H16,若A用KMnO4酸性溶液氧化,则仅得到一种二元酸B,A应为对称结构,不饱和度为$\frac{2×16+2-16}{2}$=9,能使Br2的CCl4溶液和稀冷KMnO4溶液褪色,在温和条件下可以跟H2以1:1催化加成,含有2个苯环、1个碳碳双键,B分子中有两种不同化学环境的氢原子,其原子个数比为1:2,则A中苯环含有甲基,且与碳碳双键处于对位位置,故A的结构简式为: ,B为
,B为 ,与A含有相同种类和数目的官能团(包括苯环)、且苯环上取代基位置和数量也相同的同分异构体有多种,其中任意一种的结构简式为:
,与A含有相同种类和数目的官能团(包括苯环)、且苯环上取代基位置和数量也相同的同分异构体有多种,其中任意一种的结构简式为: 等,
等,
故答案为: ;
; ;
; .
.
点评 本题考查有机物推断,侧重考查学生的分析推理能力,需要学生熟练掌握不饱和烃及苯同系物的性质,难度中等.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 和
和 两种结构式互为同分异构体(a、b为不同的原子或原子团),被称为烯烃的顺反异构,试推断一氯丙烯的同分异构体(不含环状结构)共有( )
两种结构式互为同分异构体(a、b为不同的原子或原子团),被称为烯烃的顺反异构,试推断一氯丙烯的同分异构体(不含环状结构)共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体的晶格能是气态离子形成1mol晶胞时放出的能量 | |
| B. | 金属的六方最密堆积和面心立方最密堆积的空间利用率最高 | |
| C. | 钠晶胞结构如图 ,钠晶胞中每个钠原子的配位数为8 ,钠晶胞中每个钠原子的配位数为8 | |
| D. | 温度升高,金属的导电性将变弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
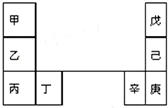 甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )
甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙与庚的原子核外电子数相差14 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
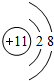 ,D元素位于周期表中的位置第三周期第ⅤⅡA族.
,D元素位于周期表中的位置第三周期第ⅤⅡA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比($\frac{{P}_{后}}{{P}_{前}}$) | 0.98 | 0.90 | 0.78 | 0.66 | 0.66 | 0.66 |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | s区元素都是金属元素 | B. | p区元素全部都是非金属元素 | ||
| C. | d区、ds区和f区由副族元素组成 | D. | s区和p区由主族和0族元素组成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com