
【题目】H3AsO3是一种剧毒物,可加入祛毒剂SnCl2来除去,反应方程式为:2H3AsO3+3SnCl2+12X=2As↓+3H2SnCl6+6H2O。下列关于该反应的说法中正确的是( )
A.还原剂是H3AsO3
B.X的化学式为HCl,是该反应的氧化剂
C.每生成0.2molAs,还原剂得到0.6mol电子
D.该反应转移2mol电子,则消耗祛毒剂SnCl2为1mol
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 异戊烷的一溴代物和1,2—二甲基环己烷的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的所有原子在同一平面上
C. 按系统命名法,化合物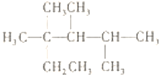 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. 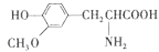 与
与![]() 二者互为同系物
二者互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水,当K闭合时,Y极上产生黄绿色气体。下列分析正确的是( )

A. 溶液中c(SO42+)减小
B. B极的电极反应:B-2e-=B2+
C. Y电极上有Cl2产生,发生还原反应
D. 反应初期,X电极周围出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效净水剂。已知:K2FeO4易溶于水,微溶于浓KOH溶液;在酸性或中性溶液中不稳定,在0~5℃的强碱性溶液中较稳定。某实验小组欲制备高铁酸钾并测定其纯度。
Ⅰ.制备高铁酸钾(夹持装置略)
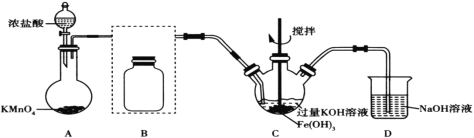
(1)装置A为氯气发生装置,其中盛放高锰酸钾的仪器名称为__。
(2)将除杂装置B补充完整并标明所用试剂__。
(3)装置C中Cl2与Fe(OH)3、KOH反应生成K2FeO4的化学方程式是____。
(4)实验时将装置C置于冰水浴中,其原因是____。
(5)实验后经结晶法得到的K2FeO4晶体仍含较多杂质,要得到更纯的晶体,还应采取的操作方法是____。
Ⅱ.测定产品纯度
(6)将wg K2FeO4粗产品溶于过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液VmL。已知该过程中涉及的离子反应主要有三个:
①Cr(OH)4+ FeO42-=Fe(OH)3↓+CrO42-+OH,
②_______,
③Cr2O72-+6Fe2++ 14H+=6Fe3+ +2Cr3+ +7H2O。
该粗产品中K2FeO4的质量分数为__(用含w、c、V的代数式表示)。若滴定管没有用标准液润洗,则测得的结果__(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如图:
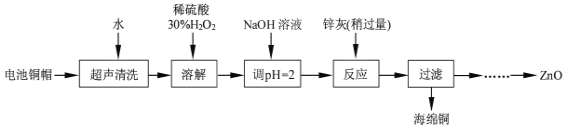
(1)①写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式___。
②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是___。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。
实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI↓(白色)+I2,2S2O32-+I2=2I-+S4O62-
滴定选用的指示剂为___,达到滴定终点观察到的现象为___。
(3)常温下,若向50mL0.0001mol/LCuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu(OH)2]=2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)=__mol/L;
(4)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0mol·L-1HNO3、1.0mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30%H2O2,使其充分反应;
②___;③过滤;④___;⑤过滤、洗涤、干燥;⑥900℃煅烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列有关该有机物的说法中正确的是

A. 能和碳酸钠溶液反应的官能团有2种
B. 1mol该有机物最多能与2molH2发生加成
C. 与![]() 互为同分异构体
互为同分异构体
D. 既可以发生取代反应又可以发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)有机化合物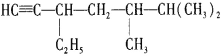 的名称是________,将其在催化剂存在下完全与H2加成,所得烷烃的名称是________。
的名称是________,将其在催化剂存在下完全与H2加成,所得烷烃的名称是________。
(2)相对分子质量为72且沸点最低的烷烃的结构简式为________。
(3)![]() 名称为________,1 mol该烃完全燃烧需消耗氧气的物质的量为______ mol。
名称为________,1 mol该烃完全燃烧需消耗氧气的物质的量为______ mol。
(4) ![]() 分子中可能共面的原子最多有_________个。
分子中可能共面的原子最多有_________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸)Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac。
请回答下列问题:
(1)化合物Cu(NH3)3(CO)Ac中,铜元素的化合价为___。
(2)该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序是___。
(3)写出基态Cu2+的电子排布式:___,向Cu2+的溶液中加入过量NaOH溶液,可生成Cu2+配位数为4的配位离子,写出该配位离子的结构式___。
(4)CO与N2互为等电子体,二者沸点较高的是___,理由是____。
(5)在一定条件下,NH3和CO2能合成尿素CO(NH2)2,尿素中碳原子和氮原子的杂化轨道类型分别是:___和___。
(6)Cu与O形成的某种化合物的晶胞结构如图所示。
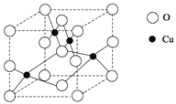
①在一个晶胞中,氧原子的数目为___。
②该化合物的化学式为____。
③晶胞的边长为apm,则该晶胞的密度为_____gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。D能与碳酸钠反应产生气体,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
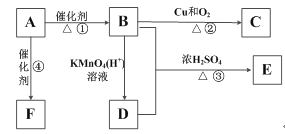
(1)A的结构简式为_____。
(2)B分子中的官能团名称是_____,F的结构简式为_______________。
(3)写出下列反应的化学方程式并指出反应类型:
②_____________________________________________:反应类型是_____;
③_____________________________________________;反应类型是_____;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com