
【题目】下列做法存在安全隐患或导致实验失败的是
A. 将1mol·L-1FeCl3溶液滴入沸水中制备Fe(OH)3胶体
B. 氢气还原氧化铜实验中,先通氢气后加热氧化铜
C. 将FeCl3稀溶液加热蒸发浓缩制备FeCl3浓溶液中
D. 用烧瓶加热液体时投入碎瓷片以防暴沸
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.只要含有金属元素的化合物一定是离子化合物
B.全部元素都由非金属元素构成的化合物一定是共价化合物
C.离子化合物一定是电解质
D.共价化合物一定是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
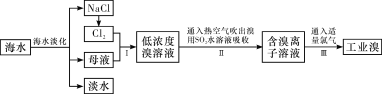
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)制备钠单质的方法之一是将熔融NaCl进行电解,写出电解化学方程式:
________________________________________________________________________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是______________。写出步骤Ⅱ中发生反应的化学方程式:_______________________________________________。
(4)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59 ℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:

①图中仪器B的名称是________,冷却水的出口为____(填“甲”或“乙”)。
②C中液体的颜色为__________________。
③D装置的作用是__________________。
(5)已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,现欲使溶液中的Cl-、Br-、I-的物质的量之比变成4∶3∶2,那么要通入Cl2的物质的量是原溶液中I-的物质的量的__________。(填选项)
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油化学工业最重要的基础原料,经乙烯为原料可以制得许多工业材料和日用品。乙烯能发生下列转化关系:

(1)A的分子为 ,化合物D的官能团名称是_____________。
(2)写出反应③、⑤ 的化学方程式 :
③____________________________________________,该反应类型是
⑤_____________________________________________。
(3)上述反应中,以生成有机产物为目标,原子利用率100%的反应有①和 。
(4)甲同学在实验室制得的乙烯中含有少量的二氧化硫,于是设计实验进行验证,将生成的气体依次通过①品红溶液 ②NaOH溶液 ③品红溶液 ④溴的四氯化碳溶液。确定含有乙烯的现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于浓硝酸、浓硫酸的说法,不正确的是( )
A.浓硝酸在见光或受热时会发生分解
B.金属与硝酸反应不产生氢气
C.可用铁和铝制品盛装浓硝酸、浓硫酸
D.往浓硫酸与铜反应后的试管中加水稀释,溶液呈蓝色,说明生成了Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.陈年老酒的香气浓是因为乙醇的特殊的香气
B.钠与乙醇的反应比钠与水的反应激烈,发生了取代反应
C.乙烯是重要的化工原料,乙烯的产量可以用来衡量一个国家的石油化工水平
D.乙烯分子所有原子都在同一平面上,丙烯也是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体。

根据图示回答问题:
(1)写出下列物质的化学式: C ,E ,I ,J 。
(2)反应①的离子方程式是_____________________;反应②的化学方程式是________________________;
(3)F与I反应的离子方程式是__________________;
(4)向一定体积的稀硫酸中加入少量的J固体,反应后的溶液与NaClO发生氧化还原反应的离子方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列FeCl3的性质中,能够证明FeCl3是共价化合物的是( )
A.FeCl3易溶于水
B.液态的FeCl3不导电
C.FeCl3常温下不易分解
D.FeCl3溶于水能电离,呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为 。
(2)由A、B、W三种元素组成的18电子微粒的电子式为 。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方式 。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种氯化物DA,熔点为800℃DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是__ (标准状况下)。
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com