
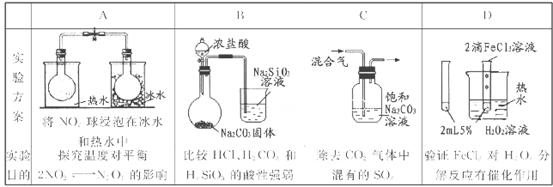
 N2O4.(g) ΔH<O. 将两个NO2平衡球分别放在热水、冰水中。平衡球放在热水中颜色加深,放在冰水中颜色变浅。说明升高温度,化学平衡向逆反应方向移动,降低温度,化学平衡向正反应方向移动。可见是温度不同化学反应移动的方向不同。正确。B.在复分解反应中,一般是强酸制取弱酸。发生反应:2HCl+Na2CO3=2NaCl+H2O+CO2↑证明:酸性HCl >H2CO3;H2O+CO2+Na2SiO3= Na2CO3+H2SiO3↓. 证明:酸性H2CO3>H2SiO3。但由于HCl有挥发性,挥发出的HCl也会与Na2SiO3发生反应:2HCl+Na2SiO3="2NaCl+" H2SiO3↓.故不能证明酸性:HCl >H2CO3>H2SiO3。错误。C.CO2、SO2都会与溶液中的Na2CO3反应。因此不能达到除去杂质的目的。错误。要验证FeCl3溶液对H2O2的分解有催化作用,应该是其它外界条件相同,只有一个加催化剂,另一个对比的不加催化剂才可以,不能同时有两个变量。错误。
N2O4.(g) ΔH<O. 将两个NO2平衡球分别放在热水、冰水中。平衡球放在热水中颜色加深,放在冰水中颜色变浅。说明升高温度,化学平衡向逆反应方向移动,降低温度,化学平衡向正反应方向移动。可见是温度不同化学反应移动的方向不同。正确。B.在复分解反应中,一般是强酸制取弱酸。发生反应:2HCl+Na2CO3=2NaCl+H2O+CO2↑证明:酸性HCl >H2CO3;H2O+CO2+Na2SiO3= Na2CO3+H2SiO3↓. 证明:酸性H2CO3>H2SiO3。但由于HCl有挥发性,挥发出的HCl也会与Na2SiO3发生反应:2HCl+Na2SiO3="2NaCl+" H2SiO3↓.故不能证明酸性:HCl >H2CO3>H2SiO3。错误。C.CO2、SO2都会与溶液中的Na2CO3反应。因此不能达到除去杂质的目的。错误。要验证FeCl3溶液对H2O2的分解有催化作用,应该是其它外界条件相同,只有一个加催化剂,另一个对比的不加催化剂才可以,不能同时有两个变量。错误。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 N2O4的ΔH<0 |
| D | 向AgCl沉淀中滴加KI溶液 | 白色沉淀 变为黄色 | 溶度积:AgI比 AgCl更小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.比较醋酸、苯酚、碳酸的酸性 |
| B.比较盐酸、醋酸、碳酸的酸性 |
| C.比较醋酸、氢硫酸、碳酸的酸性 |
| D.比较盐酸、碳酸、氢硫酸的酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验内容 | 实验目的 |
| A | 将SO2通入品红溶液中,品红褪色;加热褪色后品红溶液,溶液恢复红色 | 证明亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下KSP(BaSO4)>KSP(BaCO3) |
| C | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| D | 将浓硫酸和碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
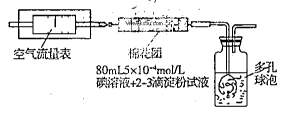
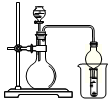
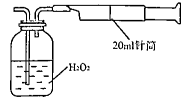 所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

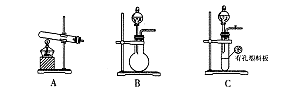
| A.图1探究NaHCO3的热稳定性 |
| B.图2证明铁生锈与空气有关 |
| C.图3定量测定H2O2的分解速率 |
| D.图4证明CH3CH2OH发生消去反应生成了乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com