
| A、混合溶液的pH<7 |
| B、混合溶液中:c(SO42-)+c(OH-)<c(HCO3-)+c(H2CO3)+c(CO32-) |
| C、混合溶液中:c(Na+)+c(H+)<2[c(SO42-)+c(CO32-)] |
| D、混合溶液中离子浓度大小顺序是:c(Na+)>c(HCO3-)>c(OH-)>c(SO42-)>c(H+) |


科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、气体的平均分子量 |
| D、气体的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、C=
| ||
B、已知常温下,氨水的电离常数为Ka,则pH约等于14+lg
| ||
| C、上述溶液中再加入0.5VmL同浓度稀盐酸,充分反应后c(Cl-)=c(NH4+)+c(NH3?H2O) | ||
| D、上述溶液中再加入VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
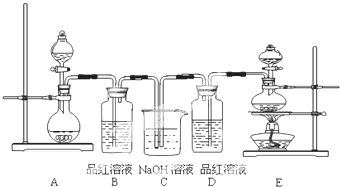
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室需要0.1mol/L NaOH溶液 250mL.根据这种溶液的配制情况,回答下列问题.
实验室需要0.1mol/L NaOH溶液 250mL.根据这种溶液的配制情况,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水加入有色布条,有色布条褪色,说明溶液中有Cl2存在 |
| B、氯水溶液呈黄绿色,有刺激性气味,说明有Cl2存在 |
| C、氯水加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在 |
| D、氯水加入NaOH溶液,氯水黄绿色消失,说明有HClO存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com