
| A. | CH3Cl | B. | CH3CHBrCH3 | C. |  | D. |  |
分析 卤代烃发生消去反应的结构特点是:只有-X相连碳的相邻碳上有氢原子的才能发生消去反应,形成不饱和键;所有卤代烃均能发生水解反应,反应实质为-X被-OH取代.
解答 解:A.CH3Cl,只含有1个碳原子,不能发生消去反应,故A错误;
B.CH3CHBrCH3中与Br原子相连碳原子的相邻碳上有氢原子,能发生消去反应,故B正确;
C.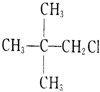 中与Cl原子相连碳原子的相邻碳上没有氢原子,不能发生消去反应,故C错误;
中与Cl原子相连碳原子的相邻碳上没有氢原子,不能发生消去反应,故C错误;
D.与Br原子相连碳原子的相邻碳上没有氢原子,不能发生消去反应,故D错误.
故选B.
点评 本题主要考查卤代烃的消去反应和水解反应,难度不大,注意卤代烃、醇发生消去反应的结构特点是:只有-X(-OH)相连碳原子的相邻碳上有氢原子的才能发生消去反应.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸根离子的质量分数是19.2% | B. | 溶质的质量分数是24.0% | ||
| C. | 溶液的物质的量浓度是2.4 mol/L | D. | 溶质和溶剂的物质的量之比是1:40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>W>Z>Y | B. | W>X>Y>Z | C. | Z>X>Y>W | D. | X>Z>Y>W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业制硫酸尾气中的SO2,是一种空气污染物,同时也是一种重要的化工原料,采用氨吸收法进行循环利用,便可以变废为宝.
工业制硫酸尾气中的SO2,是一种空气污染物,同时也是一种重要的化工原料,采用氨吸收法进行循环利用,便可以变废为宝.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成如所示的各种化合物.请回答:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成如所示的各种化合物.请回答: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com