
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(OH)CH3 | B. | CH3CH2OCH3 | C. | CH3CH2CH2OH | D. | CH3CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
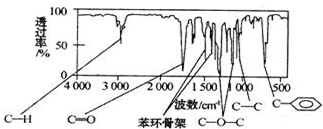
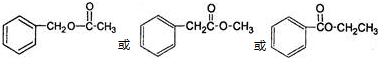 .(任写一种)
.(任写一种)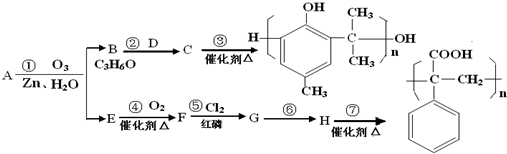
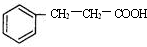 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
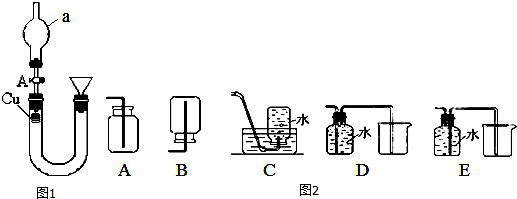
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯塑料强度大,抗腐蚀性强,可以用来包装需长时间保存的食品 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| C. | 油脂、淀粉、纤维素、蛋白质都属于天然有机高分子材料 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C14H16O4 | B. | C14H18O5 | C. | C16H22O5 | D. | C16H20O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池为一次电池 | |
| B. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 电池正极的电极反应式为:2MnO2+2H2O+2e-═Mn2O3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.请用化学用语回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.请用化学用语回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com