
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中________(填元素符号)的非金属性最强;________(填元素符号)的金属性最强,写出该元素的单质与水反应的离子方程式:___________________________________________________。
(2)表中元素③的原子结构示意图是____________。
(3)表中元素⑥、⑦的氢化物的稳定性顺序为
(4)表中元素最高价氧化物对应水化物酸性最强的是________(填化学式)。
【答案】F K 2K+2H2O=2K++2OH-+H2↑ 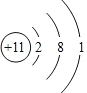 HCl HBr HClO4
HCl HBr HClO4
【解析】
由元素周期表中位置,可以知道①为H,②为Li,③为Na,④为K,⑤为F,⑥为Cl,⑦为Br。据此解答。
(1)同周期自左而右元素非金属性增强、金属性減弱,同主族自上而下非金属性减弱、金属性增强,上述元素中F元素非金属性最强,K的金属性最强;K元素的单质与水反应的离子方程式为:2K+2H2O=2K++2OH-+H2↑,故本题答案为:F;K;2K+2H2O=2K++2OH-+H2↑;
(2)③为Na,原子核外有11个电子,有3个电子层,各层电子数为2、8、1,原子结构示意图为 ,本题答案是:
,本题答案是: ;
;
(3)非金属性Cl>Br,非金属性越强,氢化物越稳定,则HCl>HBr,因此,本题正确答案是:HCl;HBr
(4)F没有正价,则非金属性除F外,Cl的非金属性越强,最高价含氧酸的酸性越强,最高价氧化物对应水化物酸性最强的酸的分子式为HClO4,本题答案是:HClO4。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的5种短周期元素。A与D、C与E分别同主族,E原子的最外层电子数比次外层少2个。A、B两元素可形成BA3气体分子甲,甲能使湿润的红色石蕊试纸变蓝且每个分子内含10个电子。请回答下列问题:
(1)气体甲溶于水所得溶液呈碱性的原因(用电离方程式表示)______________。
已知:甲、乙、丙、丁4种物质之间的转化关系如下图(注:反应条件或产物已略去)。
甲![]() 乙
乙![]() 丙
丙![]() 丁
丁
请写出从甲→乙转化的化学方程式____________________________________________。
(2)用电子式表示离子化合物D2C2的形成过程____________________________________。
(3)DAEC3和DAEC4的溶液均呈现_______(填:“酸”“碱”“中”)性,在DAEB3溶液中离子浓度由大到小的顺序是________________________________;如果将两种溶液混合后发生反应的离子方程式为____________________________________。
(4)已知A2EC3和A2EC4两种酸中酸性更强的是后者,请从分子结构和性质的关系角度解释这种差异产生的原因___________________________________。
(5)B元素的三氯化物(BCl3)常温下是一种淡黄色液体,具有三角锥型的分子结构。下列关于BCl3分子的描述中不正确的是_________________。
A.BCl3分子中B显-3价、采用SP3杂化
B.BCl3分子间可形成氢键,比PCl3难挥发
C.B、C元素的电负性B< C ,第一电离能B>C
D.BCl3遇水发生水解反应产物是BH3和HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将废弃锂离子电池再生处理,制Co3O4的工艺流程如图所示:
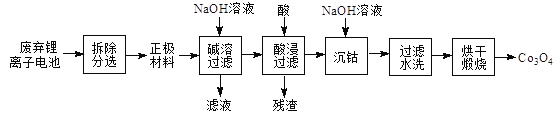
已知:锂离子电池正极材料是由活性材料(LiCoO2)、导电剂(炭黑)按一定比例粘附在铝箔上。Ksp[Co(OH)2]=1.6×10-15,本流程中完全沉淀时溶液中c(Co2+)≤1×10-6 mol/L。Co3+有强氧化性,易转化为+2价形态存在于水溶液中。
(1)锂离子电池工作时的总反应为6C+LiCoO2![]() Li1-xCoO2+LixC6,充电时阴极的电极反应式为6C+xLi++xe-=LixC6,写出放电时正极的电极反应式_____________________。
Li1-xCoO2+LixC6,充电时阴极的电极反应式为6C+xLi++xe-=LixC6,写出放电时正极的电极反应式_____________________。
(2)常用H2SO4酸浸而不用盐酸,因为盐酸酸浸LiCoO2时会生成氯气,该反应的化学方程式为_____________。
(3)当Co(OH)2完全沉淀时,浸出液中应加NaOH溶液至c(OH-)≥__________________。
(4)检验Co(OH)2沉淀洗净的方法是________________________。
(5)在空气中加热Co(OH)2至290℃时已完全脱水,到1000℃时剩余固体的质量为Co(OH)2质量的80.65%。则剩余固体的成分为____________________(填化学式)。(Co:59 Co(OH)2式量:93 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。

请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:____________________________________。
(2)乙中X是_________交换膜,向乙中加入几滴酚酞溶液,工作一段时间后铁电极附近溶液变红,请用化学用语解释相关原因______________________________________________
(3)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成的气体的物质的量为__________。
(4)欲用丙装置给铜镀银,b应是____________(填化学式)。
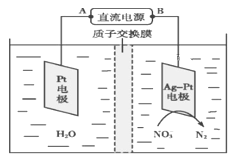
(5)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解NO3—的原理如图所示。
①Ag-Pt电极上的电极反应式为___________________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物K是某药物的前体,合成路线如图所示:
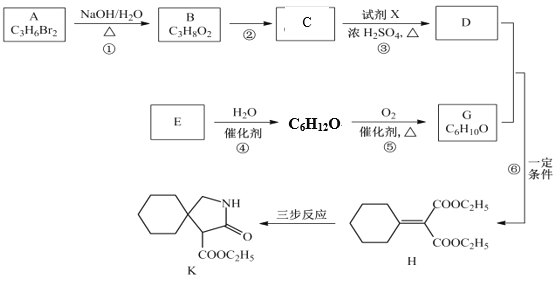
已知:R-CN ![]()
![]() ;
;
![]()
![]() +
+![]()
(1)B的结构简式是_____________。
(2)反应③的化学方程式是__________________。
(3)E属于烃,其分子式是_________________。
(4)H中含氧官能团的名称是_________________。
(5)写出满足下列条件的 K的一种同分异构体的结构简式:________________________
①遇氯化铁溶液显紫色; ②不含醚键; ③核磁共振氢谱显示峰面积之比为2:12:2:2:1
(6)H经三步反应合成K,写出J→K的化学方程式_____________________________。
![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
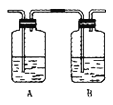
【题目】海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如右图所示。下列说法正确的是

A. b膜是阳离子交换膜
B. A极室产生气泡并伴有少量沉淀生成
C. 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D. B极室产生的气体可使湿润的KI淀粉试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
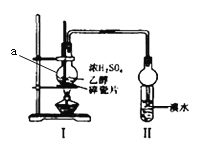
(1)仪器a的名称为____________,II中球形干燥管的作用是_______________,碎瓷片的作用___________;
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是______(填字母序号);
A.乙烯与溴水易发生取代反应
B.使溴水褪色的物质,未必是乙烯
C.温度过高导致浓硫酸被还原产生的SO2也会使溴水褪色
(3)丙同学对上述实验装置进行了改进,在I和II之间增加如图装置,则A中的试剂应为______________,其作用是______________,B中的试剂为______________。
(4)写出该实验中生成乙烯的化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:
①硫酸 ②盐酸 ③氯气 ④硫酸钡 ⑤酒精 ⑥铜 ⑦醋酸 ⑧氯化氢 ⑨蔗糖 ⑩氨气 CO2 NaHCO3 A l(OH)3 NaOH
(1)属于非电解质的为____(填序号,下同),属于弱电解质的为___,能导电的是___。
(2)写出下列反应的离子方程式
①NaHCO3溶于醋酸:______________________。
②过量CO2与NaOH溶液反应:______________。
③Cl2通入NaOH溶液中:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com