
| A. | C2H6 | B. | C3H8 | C. | C4H10 | D. | C5H12 |
分析 先判断烷烃的同分异构体,再确定烷烃的对称中心,即找出等效的氢原子,根据先中心后外围的原则,将氯原子逐一去代替氢原子,有几种氢原子就有几种一氯代烃.
解答 解:A.C2H6只有一种结构,只有一种氢原子,一氯代物有1种,故A错误;
B.丙烷只有一种结构(CH3CH2CH3),丙烷有2种氢原子,所以一氯代物有2种,故B错误;
C.C4H10有正丁烷和异丁烷,正丁烷(CH3CH2CH2CH3)有2种氢原子,所以一氯代物有2种;异丁烷CH3CH(CH3)CH3有2种氢原子,所以一氯代物有2种,故C错误;
D.戊烷有正戊烷、异戊烷、新戊烷3种同分异构体,正戊烷CH3CH2CH2CH2CH3有3种氢原子,所以一氯代物有3种;
异戊烷CH3CH(CH3)CH2CH3有4种氢原子,所以一氯代物有4种;新戊烷CH3C(CH3)2CH3有1种氢原子,所以一氯代物有1种,故D正确.
故选D.
点评 本题考查了同分异构体的判断,难度较大,先确定烃的同分异构体,再确定等效氢原子,最后根据氢原子的种类确定一氯代物的种类,会确定等效氢原子是解本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
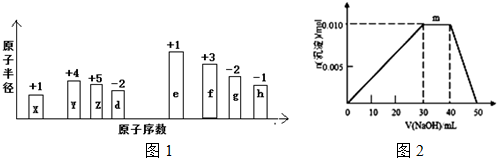
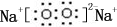 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
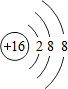
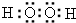 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水检验CH2═CH-CHO中是否含有碳碳双键 | |
| B. | 1 mol HCHO发生银镜反应最多生成2 mol Ag | |
| C. | 对甲基苯甲醛( )使酸性高锰酸钾溶液褪色,说明它含有醛基 )使酸性高锰酸钾溶液褪色,说明它含有醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全对 | B. | 全错 | C. | ③④ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.
原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
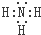 ;
;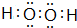 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com