
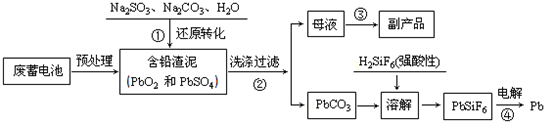


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
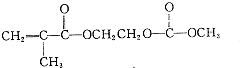
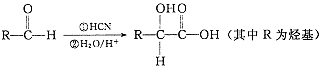
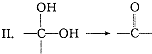
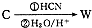 ,请写出符合下列条件的w的一种同分异构体的结构简式
,请写出符合下列条件的w的一种同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A 基态原子有3个能级,各能级中电子数相等 |
| B 基态原子核外有13种不同运动状态的电子 |
| C与B处于同一周期,且原子在该周期中电负性最大 |
| D D4+的核外电子排布与氩原子相同 |
| E 是ds区原子序数最小的元素 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Cl2与足量的铁反应,转移的电子数为2NA |
| B、在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
| C、在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2NA |
| D、将0.1 mol NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
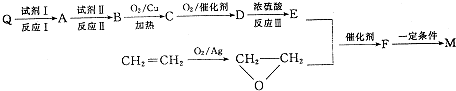
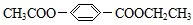 如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题:
如图是A、B分别经①、②两步反应得到各种产物的相互关系示意图,请回答下列问题: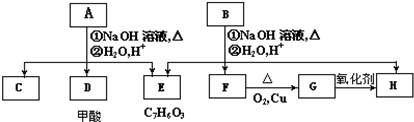
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作过程 | 实验现象 |
| 将干燥的玻璃燃烧匙中燃烧的钠迅速伸入到盛有装满CO2的集气瓶中 | 钠在盛有CO2的集气瓶中继续燃烧 |
| 反应后冷却 | 集气瓶底附着黑色颗粒,瓶壁上附着有白色物质 |
| 实验步骤 | 实验现象 |
| ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
| 实验步骤 | 所用试剂及实验操作 |
| ① | 取少量样品放入试管甲中,加入适量蒸馏水并振荡至全部溶解 |
| ② | |
| ③ | 过滤,将少量滤液盛在试管乙中 |
| ④ | 滴入几滴酚酞试液 |
| ⑤ | |
| ⑥ | 向溶液里滴入硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 试剂 | 判断方法 |
| A | 稀硝酸 | 是否生成蓝色溶液 |
| B | 稀硫酸 | 固体物质是否完全溶解 |
| C | 浓硫酸 | 是否有无色气体生成 |
| D | 稀盐酸 | 是否生成蓝色溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com