
| 次数 | V(NaOH)/mL | V(HCl)/mL |
| 1 | 20.48 | 22.46 |
| 2 | 25.00 | 21.98 |
| 3 | 25.00 | 22.36 |
| 次数 | V(NaOH)/mL | V(HCl)/mL | ||||
| 始读数V1 | 终读数V2 | V2-V1 | 始读数V1′ | 终读数V2′ | V2′-V1′ | |
| 1 | 0.10 | 25.00 | 0.00 | 24.80 | ||
| 2 | 0.00 | 24.80 | 0.10 | 22.32 | ||
| 3 | 0.00 | 24.80 | 0.00 | 24.70 | ||
| △ |
| 24.90mL+24.80mL |
| 2 |
| 24.80mL+24.70mL |
| 2 |
| c(HCl)×V(HCl) |
| V(NaOH) |
| 0.10mol?L-1×0.02475L |
| 0.0285L |


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:2011-2012学年湖北省黄冈市高三上学期期末考试理科综合_化学部分(解析版) 题型:实验题
(15分)已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。

(1)为了探究干燥的SO2能不能使品红褪色,某同学设
计了如右图所示实验装置,请指出实验装置图设计中的
不合理之处。
① ;
② 。
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色。这说明品红褪色的原因不是二氧化硫直接导致。为此,SO2能使品红的水溶液褪色的可能微粒有 。
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品红褪色的微粒是HSO—3和SO32-,不是H2SO3。你认为他的结论是否正确____,其理由是 。
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml。于两只小烧杯中,两只烧杯中同时一次性各加入20mL 0.1mol/L的亚硫酸钠,20mL 0.1mol/L的亚硫酸氢钠溶液,发现加人亚硫酸钠溶液的品红褪色较快。
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“____”内容。

②根据实验和分析,该同学得出的结论是 .
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)预测:根据已有知识和“氢铵”的名称,该小组预测其中含有![]() ,并设计实验进行验证,同时设计实验探究该化肥中的阴离子。
,并设计实验进行验证,同时设计实验探究该化肥中的阴离子。
(2)①验证和探究①![]() 的验证:取少量固体药品于试管中,然后__________________。
的验证:取少量固体药品于试管中,然后__________________。
②阴离子的探究:取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通入下列装置。观察到的现象是:溴水无明显变化,澄清石灰水变浑浊。
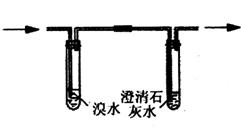
再向滴加稀盐酸反应后的试管中,加Ba(OH)2溶液,无明显现象。
结论:甲同学认为该化肥主要成分为(NH4)2CO3乙同学认为该化肥主要成分为NH4HCO3你认为该化肥主要成分为______________________。请你设计实验验证你的结论:
(3)该实验小组设计了以下两个实验方案测定该化肥的含氮量,请你阅读后进行评价:
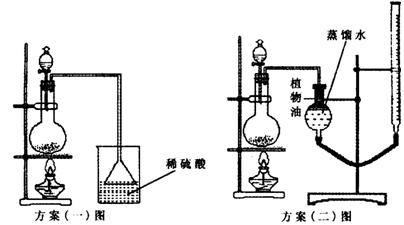
方案(一):准确称取一定质量的样品,放入上图方案(一)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置,通过实验测定烧杯增加的质量(忽略漏斗中附着溶液的质量)。然后进行计算,可得化肥的含氮量。
方案(二):准确称量一定质量(设Ag)的样品,放入上图方案(二)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置,测量生成的氨气体积(设所测体积为标况下体积)VL。然后进行计算,可得化肥的含氮量。
请你评价上述两套方案是否合理。若合理只需说明结论;若不合理,请简要说明原因,并指出修改方案(若要添加仪器、药品,请说明添加的位置、名称)
方案(一):_________________________________________________________。
方案(二):_________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com