
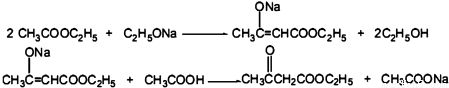

 CH3COOCH2CH3+H2O��
CH3COOCH2CH3+H2O������ ��1���������Ҵ���Ũ���ᡢ���������·���������Ӧ��������������ˮ��
��2�������к���ˮ���������װ���мӸ������Ϊ�˷�ʪ�����뷴Ӧ��ϵ���Ա�֤��Ӧ��ϵ���
��Ӧװ���������ܵ�����������������ͦ��ԭ�ϵ������ʣ���ѹװ���������ܵ���������ȴ���������������ڵõ���Ʒ��
Ϊ���������ʹ��ˮ�����������������ȴˮ��ȡ����ԭ����
��3�����ڲ����к������Σ���˲��ﴦ���μ�ϡ�����Ŀ�����к����ɵ����Σ�ʹ֮��ɲ��
���뻥������Һ�����Ϊ��Һ��
������̼������Һ�е��ܽ��С���μ�̼������Һ���Գ�ȥ���е����
̼�����ˮ����˼�̼��ص�Ŀ���Ǹ����Ʒ��
��4��3-��ͪ�������е�ߣ��������¶ȳ���95�����϶�ʱ�ͻ�ֽ⣬������Ҫ��ѹ����
��5�����ݷ�Ӧ���������֪�Ʋ��㣬������������ɲ�Ʒ�����ʵ�����0.07mol������m=nM����������3-��ͪ������������������������ʣ�
��� �⣺��1��ʵ������ȡ���������Ļ�ѧ����ʽΪ��CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O��
CH3COOCH2CH3+H2O��
�ʴ�Ϊ��CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O��
CH3COOCH2CH3+H2O��
��2�������к���ˮ���������װ���мӸ������Ϊ�˷�ֹ�����е�ˮ�������뷴Ӧ��ϵ���Ա�֤��Ӧ��ϵ���
��Ӧװ���������ܵ�����������������ͦ��ԭ�ϵ������ʣ���ѹװ���������ܵ���������ȴ���������������ڵõ���Ʒ��Ϊ���������ʹ��ˮ��������������ȴˮ��ˮ�ڷֱ�Ϊb��d��
�ʴ�Ϊ����ֹ�����е�ˮ�������뷴Ӧ��ϵ���Ա�֤��Ӧ��ϵ�������ͬ��b��d��
��3�����ڲ����к������Σ���˲��ﴦ���μ�ϡ�����Ŀ�����к����ɵ����Σ�ʹ֮��ɲ����������˻����Ӳ�����ˮ�е��ܽ�ȣ�����ܵμӵĹ��ࣻ
�÷�Һ©�����������IJ����з�Һ��
������̼������Һ�е��ܽ��С����ȥ���еĴ��ᣬ��Ҫ�μ�̼������Һ��
̼�����ˮ����˼�̼��ص�Ŀ���Ǹ����Ʒ��
�ʴ�Ϊ���к����ɵ����Σ�ʹ֮��ɲ����Һ����ȥ���еĴ�������Ʒ��
��4��3-��ͪ�������е�ߣ��������¶ȳ���95�����϶�ʱ�ͻ�ֽ⣬������Ҫ��ѹ����
�ʴ�Ϊ��3-��ͪ�������е�ߣ��������¶ȳ���95�����϶�ʱ�ͻ�ֽ⣬������Ҫ��ѹ����
��5�����ݷ�Ӧ���������֪�Ʋ��㣬������������ɲ�Ʒ�����ʵ�����0.07mol����������0.07mol��130g/mol=9.1g�����Բ�����$\frac{2.0g}{9.1g}$��100%=22%����ѡ��B��
���� ���⿼���������Ʊ���������ơ���װ��������ķ������ۡ����ʵķ����ᴿ�����ʵļ��㣬�����ֿ�����ѧ���ķ���������������������ѧʵ���������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | C3H8 | B�� | C3H7Cl | C�� | CH2Cl2 | D�� | C2H6O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
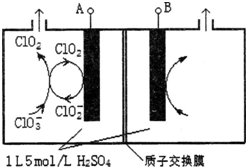 �о���Cl��N��S��Ԫ�صĻ�����Ծ���ˮ�ʡ�������Ⱦ����Ҫ���壮
�о���Cl��N��S��Ԫ�صĻ�����Ծ���ˮ�ʡ�������Ⱦ����Ҫ���壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��1��T��ʱ��A������B���巴Ӧ����C���壬��Ӧ������A��B��CŨ�ȱ仯��ͼ��ʾ������ͼʾ��֪��A��B��Ӧ����C�Ļ�ѧ����ʽΪA��g��+3B��g��?2C��g����
��1��T��ʱ��A������B���巴Ӧ����C���壬��Ӧ������A��B��CŨ�ȱ仯��ͼ��ʾ������ͼʾ��֪��A��B��Ӧ����C�Ļ�ѧ����ʽΪA��g��+3B��g��?2C��g����| ʱ��/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n��N2O4�� | 0.40 | a | 0.20 | c | d | e |
| n��NO2�� | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������A��B�ɺϳ�ӫ�⡰ħ�����в�������������֮һ��CPPO����
������A��B�ɺϳ�ӫ�⡰ħ�����в�������������֮һ��CPPO����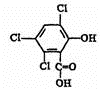 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ�й�����1.8 mol H2SO4 | B�� | �������SO2��H2�������Ϊ4��1 | ||
| C�� | ��Ӧ�й�����97.5 g Zn | D�� | ��Ӧ�й�ת��3 mol���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com