
| A、1-丁醇的结构简式:C4H10O |
B、四氯化碳的电子式: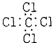 |
C、C2H4的比例模型: |
D、14C的原子结构示意图: |
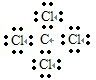 ,故B错误;
,故B错误; ,故D错误.
,故D错误.

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、FeCl3溶液中:Al3+、K+、MnO4-、SO42- |
| B、甲基橙呈黄色的溶液中:K+、Br-、S2-、ClO- |
| C、加入铝粉产生氢气的溶液中:Na+、NH4+、NO3-、Cl- |
| D、Kw/c(OH-)=0.1mol/L的溶液中:Na+、K+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将25mL水慢慢倒入盛有5.4mL浓硫酸的量筒中,并用玻璃棒不断搅拌 |
| B、将10g98%的浓硫酸沿烧杯壁慢慢注入盛有25mL水的烧杯中,并用玻璃棒不断搅拌 |
| C、若其他操作正确,量取25mL水时俯视读数,则所配稀硫酸中溶质的质量分数小于28% |
| D、配制该溶液时,若有浓硫酸沾到手上应立即用氢氧化钠溶液中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室常采用二氧化锰或硫酸铜溶液作催化剂分解过氧化氢溶液的方法制取O2 |
| B、粗盐提纯的实验,在溶解时使用玻璃棒是为了防止液体四处飞溅 |
| C、实验室常用稀硫酸与石灰石反应制取二氧化碳 |
| D、NH4H2P04不是复合肥料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滤纸上有Ag、Cu,滤液中有Ag+、Fe2+、Mg2+ |
| B、滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+、Mg2+ |
| C、滤纸上有Ag、Cu,滤液中有Fe2+、Mg2+ |
| D、滤纸上有Ag、Cu、Fe,滤液中有Fe2+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molCl2作为氧化剂得到的电子数为NA |
| B、14g氮气中含有7NA个电子 |
| C、在0℃、101kPa时,22.4L氢气中含有NA个氢原子 |
| D、NA个一氧化碳分子和0.5mol甲烷的质量比为7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氖元素的相对原子质量一定是12a/b | ||
| B、该氖原子的摩尔质量是aNAg | ||
C、Wg该氖原子的物质的量一定是
| ||
| D、Wg该氖原子所含质子数是10W/a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+SO42-OH-K+ |
| B、Cu2+NO3-Cl-H+ |
| C、H+Na+Cl-SO42- |
| D、K+H+Cl-OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO | ||||
| 方法Ⅱ | 电解法,反应为2Cu+H2O
| ||||
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| Cu2O |
| 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com