
分析 (1)加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动;
(2)向原溶液中加入Ba(NO3)2溶液,生成BaCrO4沉淀,CrO42-浓度降低,结合平衡移动原理解答;
(3)①该反应的热化学方程式的意义为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,1mol的氮气和3mol的氢气完全反应,生成2mol的氨气放出92.4kJ的热量,由此解答;
②达到平衡后,在其他条件不变的情况下降低温度,正逆化学反应速率都减慢,平衡向放热反应方向移动;增大压强,正逆反应速率都加快,平衡向气体体积减小的方向移动;若平衡后,在其他条件不变的情况下加入催化剂,正逆反应速率加快,但平衡不移动;
(4)在稀溶液中,稀的强酸跟强碱发生中和反应而生成1mo水,这时的反应热叫做中和热.
解答 解:(1)加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,溶液变黄色,故答案为:黄;H+;减小;正反应;
(2)向原溶液中逐滴加入Ba(NO3)2 溶液,生成BaCrO4为黄色沉淀,导致CrO42-减小,平衡正向移动,溶液的颜色变浅,故答案为:正反应;逐渐变为无色;
(3)①该反应的热化学方程式的意义为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,1mol的氮气和3mol的氢气完全反应,生成2mol的氨气放出92.4kJ的热量,所以表示N2 和H2反应生成2molNH3时放出的热量,故选C;
②达到平衡后,在其他条件不变的情况下降低温度,正逆化学反应速率都减慢,平衡向正反应方向移动;增大压强,正逆反应速率都加快,平衡向正反应方向移动;若平衡后,在其他条件不变的情况下加入催化剂,正逆反应速率加快,但平衡不移动,
故答案为:减小;正反应;增大;正反应;增大;否;
(4)A、在稀溶液中弱酸和弱碱反应生成1mol水,放出的热量小于中和热,因为弱电解质电离吸热,故A错误;
B、在稀溶液中HCl和NaOH反应和HNO3和KOH的反应热叫做中和热,都是-57.3KJ/mol,所以相同,故B正确;
C、在稀溶液中1mol酸和1mol碱反应放出的热量不一定相等,如一元酸和一元碱放的热量小于二元酸和二元碱放出的放热,故C错误;
D、浓硫酸稀释时放热,所以生成1mol水时放的热量大于中和热的数值,故D错误.
故选B.
点评 本题考查化学平衡的影响因素和中和热的概念的理解,中和热的概念的理解,注意分析中和热时①稀溶液②强酸强碱③生成1mol水,难度不大,注意对化学平衡移动原理的理解.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
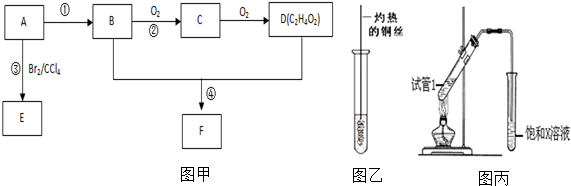
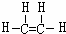 ,B中官能团的电子式为
,B中官能团的电子式为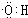 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.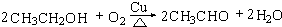 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中铜单质在反应过程中得到电子 | |
| B. | 该反应中浓硝酸被氧化 | |
| C. | 该反应中硝酸只表现氧化性 | |
| D. | 该反应中浓硝酸是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 改变条件 | 反应速率变化 | ||
| 增大 | 减小 | 不变 | ||
| (1) | 升高温度 | |||
| (2) | 充入更多的H2 | |||
| (3) | 扩大容器的体积 | |||
| (4) | 定容充入氦气 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
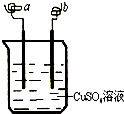
| A. | 该装置可以构成原电池,也可构成电解池 | |
| B. | a 极可能发生反应:Cu2++2e-→Cu | |
| C. | b 电极质量可能增加 | |
| D. | 该过程可能有大量气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
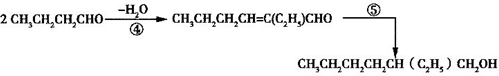
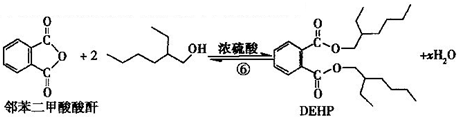
| A. | 合成过程涉及加成、消去、酯化、聚合等类型的有机反应 | |
| B. | 步骤(1)中②反应发生的条件是在NaOH/醇溶液中加热,反应类型是消去反应 | |
| C. | 步骤(1)(2)连续操作时,③、⑤消耗H2物质的量相等 | |
| D. | ⑥反应方程式中产物H2O系数x=2,及时除去⑥中反应釜内的水可提高DEHP产率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com