
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.以上四种元素的原子半径大小为W<X<Y<Z |
| B.W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电子云就是电子运动的形态 |
| B.焰色反应产生的是发射光谱 |
| C.铜原子处于基态时的核外电子排布式为3d104s1 |
| D.核外电子运动状态可以用牛顿运动定律来描述,也可以用统计方法来描述 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| B.原子核外电子的数目越多,电子的运动状态就越多 |
| C.轨道表示式,是对原子核外电子运动状态最完美的描述 |
| D.所有元素原子的最外层电子数都等于该元素的最高化合价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.NH4Br的电子式: |
B.S2-的结构示意图: |
| C.乙酸的分子式:CH3COOH |
D.原子核内有18个中子的氯原子: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.由下列短周期元素性质的数据推断元素③最高价氧化物对应的水化物碱性最强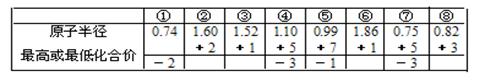 |
B.图甲表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2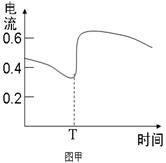  |
| C.图乙表示某一放热反应,若使用催化剂E1、E2、ΔH都会发生改变 |
| D.表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H= -571.6kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com