
【题目】室温下,向0.01 mol/L的醋酸溶液中,滴入1.00 mol/L、pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化如图所示。下列分析正确的是

A. a点,pH=2
B. b点,c(CH3COO-)>c(NH![]() )
)
C. c点,pH可能大于7
D. ab段,醋酸溶液的稀释是溶液pH增大的主要原因
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
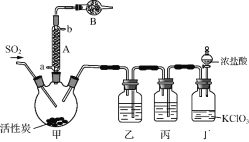
(1) 仪器A冷却水的进口_______(填“a”或“b”)。
(2) 仪器B中盛放的药品是_______。
(3) 实验所需二氧化硫用亚硫酸钠与硫酸制备,该反应的离子方程式为_______,以下与二氧化硫有关的说法中正确的是_______。
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色
B.能使品红溶液褪色的物质不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
E.可用浓硫酸干燥SO2
F.可用澄清的石灰水鉴别SO2和CO2
(4) 装置丙所盛试剂为_______,若缺少装置乙,则硫酰氯会损失,该反应的化学方程为______________。
(5) 少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H===H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是______________。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4种相邻主族短周期元素的相对位置如表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性。回答下列问题:
![]()
(1)元素X在周期表中的位置是第________周期、第________族,其单质可采用电解熔融________的方法制备。
(2)M、N、Y三种元素最高价氧化物对应的水化物中,酸性最强的是____________,碱性最强的是______。(填化学式)
(3)气体分子(MN)2的电子式为___________。(MN)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用甲苯合成苯甲醛:
 ,
,
下列说法正确的是
A. 甲苯分子中所有原子都在同一平面内 B. 反应①②③的反应类型相同
C. 一氯甲苯的同分异构体有3种 D. 苯甲醇可与金属钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)已知:pOH=-lgc(OH-)。常温下,某弱酸的钠盐(Na2XO3)溶液中微粒浓度的变化关系如下图所示。下列说法正确的是

A. 溶液加水稀释,![]() 先增大后不变
先增大后不变
B. 在NaHXO3溶液中:![]() >1
>1
C. 向Na2XO3溶液中滴加稀盐酸至溶液显中性时:c(Na+)+2c(H+)=c(HXO3-)+2c(XO32-)+2c(OH-)
D. 实线M表示pOH与![]() 的变化关系
的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是当今世界最重要的化工产品之一。
I.硫酸的各种制法。
(1)早在1000多年前,我国就已采用加热胆矾(CuSO4· 5H2O)或绿矾(FeSO4·7H2O)的方法制取硫酸。FeSO4受热分解的化学方程式:2 FeSO4![]() Fe2O3+SO2↑ +SO3↑。
Fe2O3+SO2↑ +SO3↑。
① 将FeSO4受热产生的气体通入如下图装置中,以检验产生的气体中是否含有SO3和SO2。 能说明SO2存在的实验现象是_________。

② 有同学提出虚线框内盛装NaOH溶液的装置可以换成上图右边的a装置,其中多孔玻璃球泡的作用是__________。
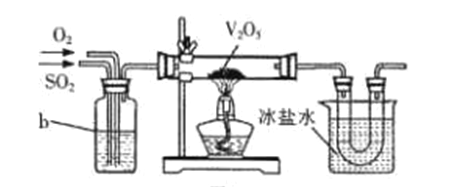
(2)目前工业上主要采用接触法制备硫酸,其中一步为:2SO2+O2![]() 2SO3。实验室模拟该过程常用下图装置进行实验。b装置中装有浓硫酸,写出b装置的作用__________(写出两点)。
2SO3。实验室模拟该过程常用下图装置进行实验。b装置中装有浓硫酸,写出b装置的作用__________(写出两点)。
Ⅱ.硫酸的性质。
(3)下图中甲试管内发生反应的化学方程式_________ ,该反应体现了浓硫酸的性质为______。
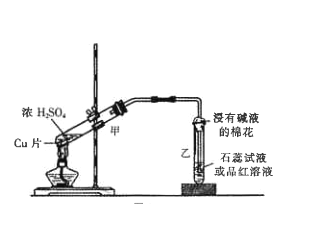
(4)当铜片与浓硫酸充分反应后,试管内并未出现蓝色溶液,而是看到白色固体,请写出检验白色固体的方法______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下图烧杯中各盛有40 mL的溶液。

(1)甲溶液pH=__________,水电离的c(OH-)=________mol/L。
(2)若分别取20 mL甲溶液和乙溶液充分混合,所得的混合溶液丙的pH=6,水电离的c(H+)=________mol/L;溶液中离子浓度大小顺序是__________。
(3)若将剩余的乙溶液全部倒入上述混合溶液丙中,所得的混合溶液pH>7,该溶液中离子浓度大小顺序是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】贝诺酯是解热镇痛抗炎药,其结构如图所示。下列有关说法正确的是

A. 分子式为C17H14O5N
B. 贝诺酯能发生银镜反应
C. 1 mol贝诺酯与H2发生加成反应最多消耗8mol H2
D. 在氢氧化钠水溶液中水解可以得到3种有机物钠盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、CO污染物处理,对建设美丽中国具有重要意义。
(1)①NO2(g)+CO(g)==CO2(g)+NO(g)△H1=-234.00kJ/mol
②1/2N2(g)+1/2O2(g)=NO(g)△H2=-89.75kJ/mol
③2NO(g)+O2(g)==2NO2(g)△H3=-112.30kJ/mol。
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为______________。
(2)某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的![]() 。
。
①0~10min内,CO的平均反应速率v(CO)=__________;
②若容器中观察到_____,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为______;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”)。
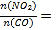
(3)在高效催化剂作用下用NH3还原NO2进行污染物处理。
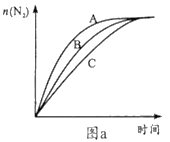
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是______(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因________(假设该温度范围内催化效率相同)。
(4)有人设想在含有NO2的酸性污水中加人填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com