
| A. | 1.2 mL,NO | B. | 2.4 mL,O2 | C. | 3.5 mL,O2 | D. | 4 mL,NO |
分析 可能发生的反应为:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,试管中O2和NO2气体按体积比1:4混合全部溶解,液体充满试管,假定全部为二氧化氮,剩余气体体积为$\frac{1}{3}$×12mL=4mL,大于实际剩余2mL气体,则说明剩余气体为NO或氧气.
若为氧气,根据4NO2+O2+2H2O=4HNO3,求出参加此反应的O2,相加得到原来的氧气;
若为NO,先根据3NO2+H2O=2HNO3+2NO求出过量的NO2,然后根据4NO2+O2+2H2O=4HNO3计算O2的体积.
解答 解:可能发生的反应为:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,试管中O2和NO2气体按体积比1:4混合全部溶解,液体充满试管,假定全部为二氧化氮,剩余气体体积为$\frac{1}{3}$×12mL=4mL,大于实际剩余2mL气体,则说明剩余气体为NO或氧气.
若为氧气,则参加反应的气体为12mL-2mL=10mL,根据4NO2+O2+2H2O=4HNO3,可知参加此反应的O2的体积为10ml×$\frac{1}{5}$=2mL,原混合气体中O2的体积为2mL+2mL=4mL;
若剩余气体为NO气体,根据3NO2+H2O=2HNO3+NO,可知过量的NO2为3×2mL=6mL,反应4NO2+O2+2H2O=4HNO3消耗的气体总体积为12mL-6mL=6mL,则反应消耗的氧气为6mL×$\frac{1}{5}$=1.2mL,
故选A.
点评 本题考查了氮氧化物的性质、混合物有关计算,难度中等,关键是分析剩余气体的成分,再结合方程式讨论计算.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃都含有卤原子 | |
| B. | 所有卤代烃都是通过取代反应制得的 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 所有卤代烃都是难溶于水,密度比水小的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4H的电子式为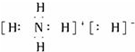 | |
| B. | NH4Cl的电子式为 | |
| C. | NH4H含有极性共价键和离子键 | |
| D. | NH4H固体投入少量热水中,有两种气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
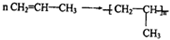 ,该反应的反应类型为加聚反应.
,该反应的反应类型为加聚反应.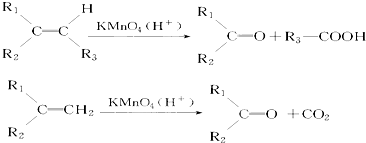
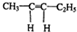 .若该烯烃的一种同分异构体与酸性高锰酸钾溶液反应得到的产物为二氧化碳和丁酮(
.若该烯烃的一种同分异构体与酸性高锰酸钾溶液反应得到的产物为二氧化碳和丁酮(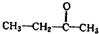 ),则此烯烃的结构简式为
),则此烯烃的结构简式为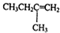 ,名称为2-甲基-1-丁烯;丁酮中官能团的名称为羰基.
,名称为2-甲基-1-丁烯;丁酮中官能团的名称为羰基.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
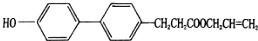
| A. | 能发生加成、加聚、水解和氧化反应 | |
| B. | 分子式为C18H20O3 | |
| C. | 该化合物最多有12个碳原子共平面 | |
| D. | 一定条件下1molR最多可以消耗2molNaoH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石膏(CaSO4•2H2O) | B. | 硫铁矿(FeS2) | ||
| C. | 纯碱(NaHCO3) | D. | 芒硝(Na2SO4•10H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=$\sqrt{{K}_{W}}$mol•L-1的溶液:Fe3+、K+、Cl-、CO32- | |
| B. | c(NH4+)=0.1mol•L-1的(NH4)2Fe(SO4)2溶液:H+、Al3+、Br-、I- | |
| C. | 加水稀释时,$\frac{c(O{H}^{-})}{c({H}^{+})}$值明显增大的溶液:K+、NH4+、CO32-、MnO4- | |
| D. | 通入SO2的饱和溶液:Ca2+、K+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -OH的电子式: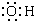 | |
| B. | 硫离子结构示意图: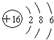 | |
| C. | 氢氧化铜电离方程式:Cu(OH)2═Cu2++2OH- | |
| D. | 乙酸的分子式:C2H4O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com