
下图是一个实验室测定黄铁矿中硫的百分含量的装置.
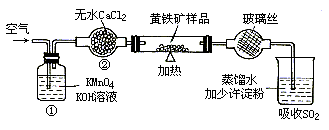
实验时有如下操作:(A)将磁管中样品加热到800~850℃.(B)称取研细的黄铁矿样品.(C)连接全部仪器,使其成为整套实验装置,并检查气密性.(D)将样品小心放入盛器中,再将盛器小心地推入磁管中部.(E)以每分钟1 L的速度鼓入空气.(F)用标准碘液滴定含淀粉的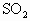 水溶液.
水溶液.
(1)正确的实验步骤,其操作编号是_________.
(2)装置①的作用是________;装置②的作用是________.
(3)应根据_________现象判断滴定已达到终点而停止鼓入空气.
(4)碘液跟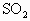 水溶液发生反应的化学方程式是_________.
水溶液发生反应的化学方程式是_________.
(5)假定矿样品的硫全部转化为二氧化硫,并全部被水吸收.著称得矿样的质量是0.12g,滴定管中碘液初读数为0.10mL,未读数为25.60mL,标准碘液的浓度为0.05mol/L,则黄铁矿样品中的含硫量是__________.
科目:高中化学 来源: 题型:

| CaCO3用量 | 未加CaCO3时 | 加约四分之一时 | 加一半时 | 全部加完时 |
| 读数/g | 318.3 | 325.3 | 334.5 | 359.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

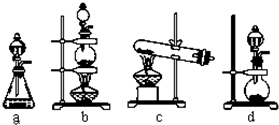
①设计甲装置的目的是_________________。甲装置__________(填“能”或“不能”)用乙装置来代替。
②装置乙中盛有的液体是__________,该装置可看作是一个___________(填某仪器名称)。
(2)在氮的化合物中,有一类盐叫亚硝酸盐,如亚硝酸钠(NaNO2)等。NaNO2是一种潜在的致癌物质,过量或长期使用会对人产生危害。由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生过被误当食盐使用的事件。已知:HNO2是一种弱酸,不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2;AgNO2是一种难溶于水易溶于酸的化合物。试回答下列问题:
①人体正常的血红蛋白中应含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是_____________。
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
②下列说法中,能用来区别NaNO2和NaCl的是______________。
A.测定这两种溶液的pH
B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI淀粉试液来区别
③把新制氯气通入到NaNO2溶液中,氯水褪色,生成NaNO3和HCl,请写出此反应的离子方程式______________。
④为了测定某样品中NaNO2的含量,可以使用标准?KMnO4?溶液进行滴定,试回答:KMnO4溶液在滴定过程中作____________(填“氧化剂”或“还原剂”),该滴定过程_____________(填“要”或“不要”)另加指示剂。
⑤已知HNO2的酸性比醋酸略强,某同学在家中进行鉴别NaNO2与NaCl的实验,但他家中只有浓醋酸,请问该实验能否成功?____________(填“能”或“不能”),请说明理由_______
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:山东省枣庄市2010届高三年级调研考试理综(化学部分)试题 题型:填空题
(8分)[化学—化学与技术]
粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。在实验室条件下以硫酸铜溶液为电解液,用电解的方法对粗铜提纯,并对阳极泥和电解液中金属进行回收和含量测定。回答以下问题;
(1)步骤一:电解精制:电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,对电解液进行处理。
(2)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— = AuCl4— | >>1 |
查看答案和解析>>
科目:高中化学 来源:山东省枣庄市2010届高三年级调研考试理综(化学部分)试题 题型:填空题
(8分)[化学—化学与技术]
粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。在实验室条件下以硫酸铜溶液为电解液,用电解的方法对粗铜提纯,并对阳极泥和电解液中金属进行回收和含量测定。回答以下问题;
(1)步骤一:电解精制:电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,对电解液进行处理。
(2)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
|
序号 |
反应 |
平衡常数 |
|
1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+ + 4Cl— = AuCl4— |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比l:3的混合物).请你简要解释金能够溶于王水的原因 。
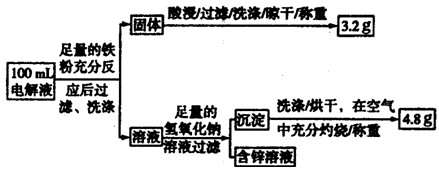
(3)电解液含量的测定:下图是该小组探究电解液的一个实验流程:

则100mL滤液中Cu2+ 的浓度为 mol·L—1 ,Fe2+的浓度为 mol·L—1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com