
【题目】将一定量Na2CO3、NaHCO3组成的混合物溶于水配成50 mL溶液,逐滴加入稀盐酸,得到各成分物质的量变化如图所示(忽略溶液混合导致的体积变化,已知1 mol=1000 mmol)。
下列说法不正确的是
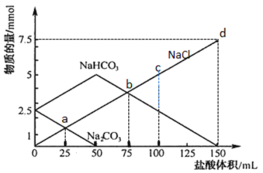
A.盐酸的物质的量浓度为0.05 mol·L-1
B.c点溶液中c(NaCl)=0.05 mol·L-1
C.a点溶液中发生反应的离子方程式为:CO![]() + H+ = HCO
+ H+ = HCO![]()
D.b点和d点所处的溶液中n(Na+)相等
【答案】B
【解析】
Na2CO3和HCl的反应分为两步:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O;加入50mL盐酸时,Na2CO3的物质的量由2.5mmol降为0,此时溶液中的溶质为NaHCO3和NaCl,之后加入到150mL盐酸时,NaHCO3的物质的量由5mmol降为0,此时溶液中的溶质为NaCl。
A.0~50mL发生反应Na2CO3+HCl=NaHCO3+NaCl,n(Na2CO3)=0.0025mol,根据反应方程式可知50mL盐酸中n(HCl)=0.0025mol,所以c(HCl)=![]() =0.05mol/L,故A正确;
=0.05mol/L,故A正确;
B.c点加入100mL盐酸,根据元素守恒n(NaCl)= n(HCl)=0.1L×0.05mol/L=0.005mol,此时溶液的体积为50mL+100mL=150mL,所以c(NaCl)=![]() ,故B错误;
,故B错误;
C.据图可知a点Na2CO3还有剩余,所以发生的离子反应为CO![]() +H+ =HCO
+H+ =HCO![]() ,故C正确;
,故C正确;
D.混合溶液中滴加的是HCl,所以溶液中n(Na+)始终不变,b点和d点所处的溶液中n(Na+)相等,故D正确;
故答案为B。


 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】中国首款完全自主知识产权民用客机C919的钛合金用量达9.3%。制备海绵钛的化学方程式为TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
(1)该反应中,作为还原剂的物质是____,Ti元素的化合价__(填“升高”或“降低”)
(2)若反应中消耗了2 mol Mg,则生成___molTi。转移电子的物质的量为____mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
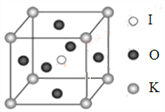
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是()
A.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.用铜作电极电解食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.向氧化铁中加入氢碘酸:Fe2O3+6H+=2Fe3++3H2O
D.向一定量明矾溶液中滴加Ba(OH)2溶液至生成沉淀的物质的量最多:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续,合成其原理如图所示。下列说法不正确的是

A. 过程I得到的Li3N的电子式为![]()
B. 过程Ⅱ生成W的反应为Li3N+3H2O=3LiOH+NH3↑
C. 过程Ⅲ涉及的阳极反应为4OH--4e-=O2↑+2H2O
D. 过程I、Ⅱ、Ⅲ均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
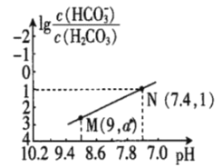
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D,E,F均为周期表中前36号元素,且原子序数依次增大.A,B,C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等.A,F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道.D和E原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
D | 738 | 1451 | 7733 | 10540 |
E | 578 | 1817 | 2745 | 11578 |
(1)A,B,C三种元素的电负性最大的是__(填写元素符号),D,E两元素中D的第一电离能较大的原因是__.
(2)F基态原子的核外电子排布式是__;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于__光谱(填“吸收”或“发射”).
(3)根据等电子原理,写出AB+的电子式:__.
(4)已知:F3+可形成配位数为6的配合物.组成为FCl36H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1.则绿色配合物的化学式为__.
A [CrCl(H2O)5]Cl2H2O B [CrCl2(H2O)4]Cl2H2O
C [Cr(H2O)6]Cl3 D [CrCl3(H2O)3]3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下图所示。下列叙述正确的是
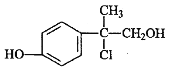
A. 有机物A可与溴水发生加成反应
B. 1mol有机物A能消耗2molNaOH
C. 有机物A不能使酸性高锰酸钾溶液褪色
D. 有机物A分子中所有碳原子可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,流程如下:
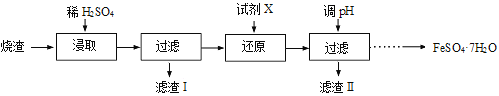
(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为 。能提高烧渣浸取速率的措施有 (填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是 (填字母)。
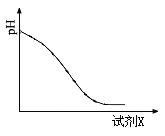
A.Fe粉 B.SO2 C.NaI
还原结束时,溶液中的主要阴离子有 。
(3)滤渣Ⅱ主要成分的化学式为 ;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是 、 过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com