
| A.滴定管用水冲洗后即注入标准液 | B.锥形瓶里有少量水 |
| C.滴定前标准液在“0”刻度以上 | D.滴定管尖端未充满液体 |
 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源:不详 题型:单选题
| A.实验剩余的药品一般不能放回原试剂瓶 |
| B.溶解时用玻璃棒搅拌 |
| C.可燃性气体点燃前必须验纯 |
| D.过滤时玻璃棒靠在三层滤纸处 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.450 mL,52.7 g | B.500 mL,58.5 g |
| C.450 mL,58.5 g | D.500 mL,52.7 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 Na2S2O3,
Na2S2O3,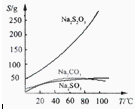
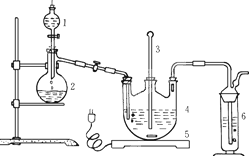
| A.BaCl2溶液 | B.浓H2SO4 |
| C.酸性KMnO4溶液 | D.NaOH溶液 |
 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
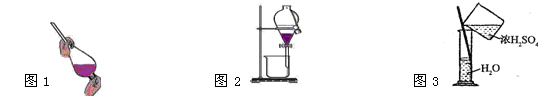
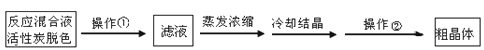
| A.萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的 |
| B.可以采用蒸发浓缩、冷却结晶的方法从硝酸钾溶液中获得硝酸钾晶体 |
| C.将乙醇与水分离,如图1、图2操作 |
| D.稀释浓H2SO4,如图3操作 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
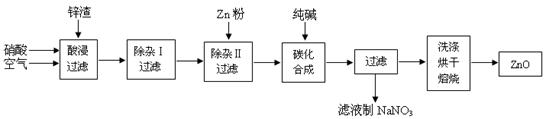
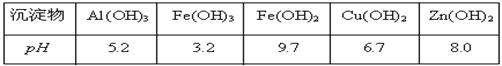
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制0.1mol·L-1的H2SO4溶液时,量取浓硫酸小心注入盛有少量蒸馏水的容量瓶中 |
| B.若要除去CO2中含有的少量SO2气体,可通过盛有饱和NaHCO3溶液的洗气瓶 |
| C.在实验室中使用金属钠时若不慎着火,可立即用细沙灭火 |
| D.测溶液pH时,可用干净的玻璃棒蘸取溶液滴到放在表面皿上的pH试纸上 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 | 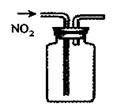 | 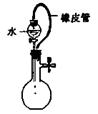 | 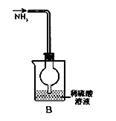 |
| A.称量25 .0g氯化钠固体 | B.收集NO2气体 | C.检验出此装置漏气 | D.吸收NH3不会造成倒吸(尾气处理装置略) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com