
【题目】(化学——选修3:物质结构与性质)
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______(填元素符号),其中D原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是______(填分子式),原因是________;B和D的氢化物所属的晶体类型分别为_______和_______。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为_______,中心原子的杂化轨道类型为_______,中心原子的价层电子对数为_____________。
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, 列式计算晶体F的密度(g.cm-3)______________________________。
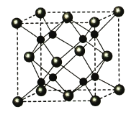
【答案】O1s22s22p63s23p5(或[Ne] 3s23p5)O3O3相对分子质量较大,范德华力大离子晶体分子晶体三角锥形sp34![]()
【解析】
因为A、B、C、D四种元素的原子序数依次增大,A2-和B+具有相同的电子构型,则A是O,B是Na;C、D为同周期元索,C核外电子总数是最外层电子数的3倍,则C是P;D元素最外层有一个未成对电子,所以D是氯元素,据此分析可得结论。
(1)非金属性越强,电负性越大,则四种元素中电负性最大的是O;Cl的原子序数是17,则根据核外电子排布可知D原子的核外电子排布布式为1s22s22p63s23p5(或[Ne] 3s23p5);(2)氧元素有氧气和臭氧两种单质,由于O3相对分子质量较大,范德华力大,所以中沸点高的是O3;B和D的氢化物分别是NaH和HCl,所属的晶体类型分别为分子晶体和离子晶体,故答案为:O3相对分子质量较大,范德华力大、离子晶体、分子晶体;(3)C和D反应可生成组成比为1:3的化合物E,即E是PCl3, 其中P含有一对孤对电子,其价层电子对数是4,所以E的立体构型为三角锥形,中心原子的杂化轨道类型为sp3,故答案为:三角锥形、sp3、4;(4)由晶胞结构和均摊法分析可知其中含有的钠离子个数为8(全部在晶胞内),氧离子个数为8×![]() +6×
+6×![]() =4,晶胞的质量为
=4,晶胞的质量为![]() ,晶胞的体积为(0.566×10-7)3cm3,则晶体F的密度为
,晶胞的体积为(0.566×10-7)3cm3,则晶体F的密度为![]() =2.27gcm-3。
=2.27gcm-3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B.  =1×1012的溶液中:K+、Na +、CO32-、NO3-
=1×1012的溶液中:K+、Na +、CO32-、NO3-
C. c(Fe2+) =1mol·L1的溶液中:K+、NH4+、MnO4-、SO42-
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.把5.1 g镁铝合金的粉末放入过量的盐酸中,得到5.6 L H2(标准状况下)。
(1)合金中镁的物质的量为_______。
(2)写出该合金溶于足量NaOH溶液的化学方程式:_______。
Ⅱ.在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示。
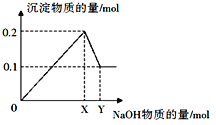
(1)生成Mg(OH)2的质量为__________。
(2)X=_______;Y=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中不正确的是
A. 丁达尔现象可用来区别胶体与溶液
B. 溶液、胶体、浊液的根本区别是分散质粒子直径的大小
C. 胶体在一定条件下会发生聚沉
D. 胶体粒子能通过半透膜,不能通过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )

A. 6:1 B. 3:1 C. 2:1 D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列事实的方程式不正确的是( )
A. Al溶于NaOH溶液:2Al + 2H2O + 2NaOH ==2NaAlO2 + 3H2↑
B. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH-=SiO32- + H2O
C. 热的浓NaOH溶液与NH4Cl液混合产生气体:NH4+ + OH-![]() NH3↑+ H2O
NH3↑+ H2O
D. 实验室用NaOH溶液吸收多余的NO2:3NO2 +2OH—=2NO3—+H2O+NO↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6 g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入22.4 L的CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com