
| A. | 能全部透过半透膜 | |
| B. | 能产生丁达尔效应 | |
| C. | 所得液体一定能导电 | |
| D. | 所得混合物不稳定,静置后容易产生沉淀 |
分析 “纳米材料”是指粒子直径在几纳米到几十米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间,即所得的为胶体,根据胶体的性质来解答.
解答 解:分散系中分散质的直径在1nm~100nm之间的属于胶体分散系,
由“纳米技术”是指粒子直径在几纳米到几十米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间,则该混合物属于胶体.
A.胶体不能通过半透膜,故A错误;
B.胶体具有丁达尔现象,故B正确;
C.胶粒不一定带电,液体分散剂若为非电解质,则不能导电,故C错误;
D.胶体是介稳体系,比较稳定,不易产生沉淀,故D错误.
故选B.
点评 本题考查分散系的判断及胶体的性质,明确纳米材料的直径是解答本题的关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 一种滤液显碱性,另一种滤液显中性 | |
| B. | 两种滤液均显碱性 | |
| C. | 一种滤液显碱性,另一种滤液显酸性 | |
| D. | 两种滤液均显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝常温下不与氧气反应 | |
| B. | 铝常温下不与浓硫酸反应产生气体,是因为发生钝化 | |
| C. | 向氯化铝溶液中逐滴加入氨水的现象是先产生白色沉淀,后白色沉淀又溶解 | |
| D. | 氧化铝只能与酸反应,不能与碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量浓盐酸 | B. | 加入几滴氯化铜溶液 | ||
| C. | 加入适量蒸馏水 | D. | 加入适量的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
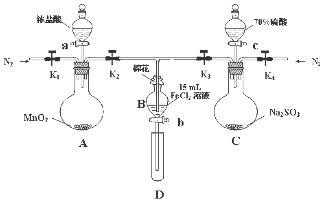 为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com