
【题目】用10mL 0.1mol·L-1的BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
A.1:3:3B.3:1:1C.3:2:2D.1:2:3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】据报道美国准备试验绿色航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,结构如图,它比肼燃烧释放能量更高,更安全、环保。下列说法不正确的是( )

A.羟基硝酸铵中各原子共平面
B.固态时羟基硝酸铵是离子晶体
C.羟基硝酸铵中含有离子键和共价键
D.9.6g羟基硝酸铵中含有0.2NA个离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:

Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。
Ⅲ.接着再向B中通入一定量的SO2气体。
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。
(1)棉花中浸润的溶液为____________,目的是________________。
(2)实验室制备氯气的化学方程式为______________________。
(3)过程Ⅲ中一定发生反应的离子方程式为______________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是_____________________。
(4)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是_______________。
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是

A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法错误的是( )
A. 18g重甲基(-CD3)中含有的电子数为9NA
B. 22.4L(标准状况)CH2Cl2中含C-H键数为2NA
C. 10g34%H2O2溶液与足量的酸性KMnO4溶液充分反应,转移的电子数为0.2NA
D. 0.1mol由乙烯与乙醇组成的混合物完全燃烧所消托的氧气分子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
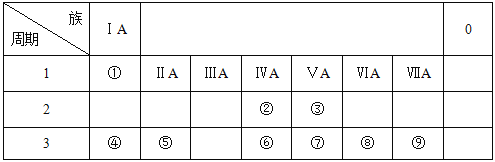
请按要求回答下列问题:
(1)⑧的原子结构示意图是__________;
(2)③、⑤、⑦三种元素的原子半径由大到小的顺序是 __________(填元素符号);
(3)元素②的气态氢化物比元素⑥的气态氢化物的稳定性较 __________(填 “强”或“弱”);
(4)④和⑨两种元素组成的化合物与AgNO3溶液反应的离子方程式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com