
 7N2+12H2O 或4NH3+6NO
7N2+12H2O 或4NH3+6NO  5N2+6H2O(2分)
5N2+6H2O(2分)

科目:高中化学 来源:不详 题型:单选题

| A.合金的熔点比其成分金属低,通常比成分金属具有更优良的金属特性 |
| B.铜银都能与稀硝酸反应,收集到的V L气体全为NO |
| C.操作Ⅰ是过滤,操作Ⅱ是洗涤,操作Ⅲ应是烘干 |
| D.根据反应收集到的气体体积可以计算铜和银的质量分数 |
查看答案和解析>>
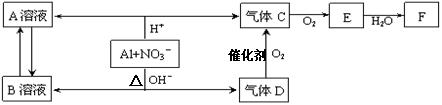
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
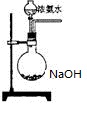
科目:高中化学 来源:不详 题型:实验题

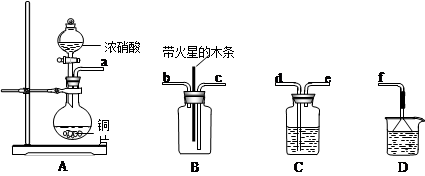
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.气体遇浓盐酸产生白烟 |
| B.气体使湿润的蓝色石蕊试纸变红 |
| C.气体通人酚酞溶液中,溶液变红 |
| D.气体使湿润的红色石蕊试纸变蓝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

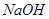 溶液的作用是________________。
溶液的作用是________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2和H2在点燃或光照条件下可合成氨 |
| B.氨是共价化合物,硝酸是离子化合物 |
| C.氨气遇到浓硝酸会发生反应产生白烟 |
| D.由氨制取硝酸过程中,氮元素被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
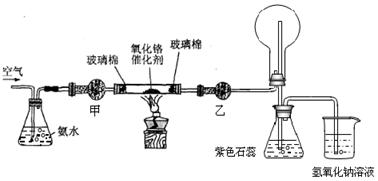
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com