
| ���� | ���� | ���� | |
| A | �����õ������Ӳ���ϡ������Һ�� | ���ܽ⣬������H2���ų� | �����ױ��һ�����ǿ |
| B | ��һ��ɫ��Һ�еμ���ˮ��CCl4�������� | �ϲ���Һ����ɫ | ԭ��Һ����I- |
| C | �ýྻ��˿պȡ��Һ������ɫ��Ӧ | ����ʻ�ɫ | ԭ��Һ����Na+����K+ |
| D | ��һ��Ũ�ȵ�Na2SiO3��Һ��ͨ������CO2���� | ���ְ�ɫ���� | H2SiO3�����Ա�H2CO3�� |
| A��A | B��B | C��C | D��D |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1mol?L-1��ˮ�У�c��OH-��=c��NH4+�� |
| B����0.1mol?L-1 CH3COONa��Һ�У�c��OH-��=c��CH3COOH��+c��H+�� |
| C��������������ʵ���Ũ�ȵ�NaX������HX��Ϻ����Һ�У�c��Na+����c��HX����c��X-����c��H+����c��OH-�� |
| D��0.1mol?L-1ij��Ԫ����ǿ����NaHA��Һ�У�c��Na+��=2c��A2-��+c��HA-��+c��H2A�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��S2Cl2�����в��������Ӽ� |
| B��S2Cl2�����и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ |
| C��S2Cl2��Һ̬�²��ܵ��� |
| D��S2Cl2��ˮ��Ӧ�����ɵ�����ͨ��ʯ����Һ�У���������Һ�ȱ�����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������Һ�еı����Է���ȡ����Ӧ |
| B����������Һ�����ܼ� |
| C��Ӧ�ý���������������Һ |
| D������Һ�еı���һ�ְ�ɫҺ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A���ڢ� | B���٢ܢ� |
| C���٢ڢ� | D���٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��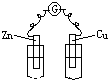 ϡH2SO4 |
B��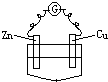 �Ҵ� |
C��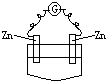 ϡH2SO4 |
D��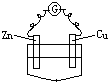 CuSO4��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A������С�մ��ƶ�����̼ |
| B����ͭ��ϡ���ᷴӦ��һ������ |
| C�����Ȼ����Ũ����������Һ��Ӧ�ư��� |
| D�����Ȼ�����Ũ���ᷴӦ���Ȼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ѧѧ���е�ƽ�����۰�������ѧƽ�⡢����ƽ�⡢�ܽ�ƽ��ȣ��Ҿ�������������ԭ������ش��������⣮
��ѧѧ���е�ƽ�����۰�������ѧƽ�⡢����ƽ�⡢�ܽ�ƽ��ȣ��Ҿ�������������ԭ������ش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| SCY�մ� |
| һ������ |
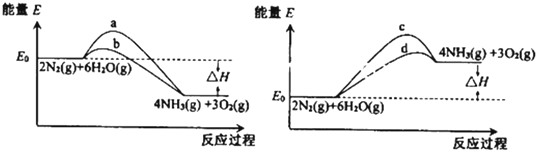
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com