
分析 先根据含氧量和相对分子质量的范围,得出氧原子数,然后根据氧元素的质量分数求得有机化合物的相对分子质量,进而计算M的化学式,最后确定M中最多含有的碳氧双键数目.
解答 解:碳和氢的质量分数之和为51.52%,则氧的质量分数为:1-51.52%=48.48%,有机化合物的相对分子质量介于118和150之间,所以氧原子个数大于:$\frac{118×48.48%}{16}$=3.58,小于$\frac{150×0.4848}{16}$=4.55,即该烃中氧原子为4个,
所以该有机物分子质量为:$\frac{16×4}{48.48%}$=132,其中C、H的相对原子质量之和为:132-16×4=68,
由余商法$\frac{68}{14}$=4…12,可确定分子式为C5H8O4,
C5H8O4与不饱和度为:$\frac{5×2+2-8}{2}$=2,所以分子中最多含有2个碳氧双键,
答:M分子中最多含有2个碳氧双键.
点评 本题主要考查有机物分子式和结构的确定,题目难度中等,根据题干信息计算氧原子数、确定分子式为解答该题的关键,注意掌握常见有机物结构与性质.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=y | B. | x>y | C. | x<y | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 10种 | C. | 12种 | D. | 13种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
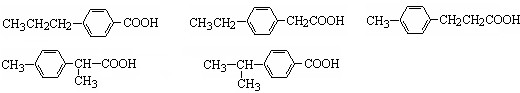 中任意两种.
中任意两种.

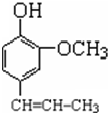 +CH3CH2Cl$\stackrel{一定条件下}{→}$
+CH3CH2Cl$\stackrel{一定条件下}{→}$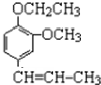 +HCl;
+HCl;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴 | |
| B. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有HNO3和H2SO4,将其倒入NaOH溶液中,静止,分液 | |
| D. | 乙烯中混有SO2,将其通入酸性高锰酸钾溶液中洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 软脂酸 C17H35COOH | B. | 新戊烷 C(CH3)4 | ||
| C. | 甘氨酸 H2NCH2COOH | D. | 甘油 CH2(OH)CH(OH)CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com