
 CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.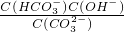 ,
,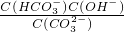 ;
;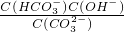 =2×10-4mol/L,
=2×10-4mol/L, =0.027mol/L,同一反应中同一时间段内,各物质的反应速率之比等于计量数之比,所以二氧化碳的反应速率为0.027mol/L;
=0.027mol/L,同一反应中同一时间段内,各物质的反应速率之比等于计量数之比,所以二氧化碳的反应速率为0.027mol/L; =
=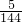 L/mol,
L/mol,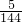 L/mol;B.
L/mol;B.

科目:高中化学 来源: 题型:
下列分子或离子在指定的分散系中能大量共存的一组是
A.银氨溶液: Na+、K+、NO3-、NH3·H2O
B.空气: C2H2、CO2、SO2、NO
C.氢氧化铁胶体: H+、K+、S2-、Br-
D.高锰酸钾溶液: H+、Na+、SO42-、葡萄糖分子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省成都市高三第二次诊断考试理综化学试卷(解析版) 题型:选择题
下列分子或离子在指定的分散系中能大量共存的一组是( )
A.银氨溶液: Na+、K+、NO3-、NH3·H2O
B.空气: C2H2、CO2、SO2、NO
C.氢氧化铁胶体: H+、K+、S2-、Br—
D.高锰酸钾溶液: H+、Na+、SO42-、葡萄糖分子
查看答案和解析>>
科目:高中化学 来源:2014届河南省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列分子或离子在指定的分散系中能大量共存的一组是
A.纯碱溶液:NH4+、K+、NO3-、NH3·H2O
B.空气:C2H2、CO2、SO2、NO
C.氢氧化铁胶体:H+、K+、S2-、Br-
D.高锰酸钾溶液:H+、Na+、SO42-、H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com