
已知:C(s)+O2(g)=CO2(g);△H=﹣393.5kJ/mol
H2(g)+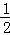 O2(g)=H2O(l);△H=﹣241.8kJ/mol
O2(g)=H2O(l);△H=﹣241.8kJ/mol
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为()
A. 2:3.25 B. 12:3.25 C. 1:1 D. 393.5:241
科目:高中化学 来源: 题型:
在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g)⇌C(g)+D(g)已达平衡的是()
A. 混合气体的压强 B. 混合气体的密度
C. 混合气体的分子数目 D. 混合气体的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与氢键有关的是( )
A. 水加热到很高的温度都难以分解
B. 水结冰成体积膨胀,密度减少
C. CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高
D. HF、HCI、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
图1是元素周期表的一部分,表中所列的字母分别代表一种化学元素.

试回答下列问题:
(1)请写出字母O代表的元素符号 ,该元素在周期表中的位置 .
(2)第三周期8种元素按单质熔点高低的顺序如图2,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图2中的序号).
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是 (填化学式),试从结构角度加以解释: .
(4)k与l形成的化合物kl2的电子式是 ,它在常温下呈液态,形成晶体时,属于
晶体.
(5)i单质晶体中原子的堆积方式如图3(甲)所示,其晶胞特征如图3(乙)所示,原子之间相互位置关系的平面图如图3(丙)所示.
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
晶胞中i原子的配位数为 ,一个晶胞中i原子的数目为 ,该晶体的密度为 (用M、NA、d表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气、一氧化碳、辛烷、甲烷燃烧的热化学方程式分别为:
H2(g)+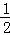 O2(g)=H2O(l)△H=﹣285.8kJ/mol
O2(g)=H2O(l)△H=﹣285.8kJ/mol
CO(g)+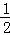 O2(g)=CO2(g)△H=﹣282.6kJ/mol
O2(g)=CO2(g)△H=﹣282.6kJ/mol
C8H18(l)+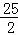 O2(g)=8CO2(g)+9H2O(l)△H=﹣5472kJ/mol
O2(g)=8CO2(g)+9H2O(l)△H=﹣5472kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=﹣889.6kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是()
A. H2(g) B. CO(g) C. C8H18(l) D. CH4(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
有一环保汽车,是以氢气作燃料的,请按题目要求作答:
(1)氢气在发动机内燃烧过程中,生成物只有水蒸气,不会使空气中的 含量偏高,因而能减缓温室效应现的发生.
(2)如果每mol氢气燃烧后生成水蒸气并放出241.8kJ的热量,写出氢气燃烧的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组溶液电解一段时间后,再加入相关物质,溶液能恢复原状况的是()
电解质溶液 阳极 阴极 加入的物质
A NaCl溶液 碳 铁 盐酸
B NaOH溶液 碳 碳 水
C 硫酸铜溶液 铜 碳 硫酸铜
D 硫酸 铁 碳 H2O
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐与碱反应制得白色纯净的Fe(OH)2沉淀.某研究性小组在研究制备Fe(OH)2的过程中,按图进行实验,最终在两极间的溶液中首先观察到白色沉淀.
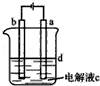
(1)请从所提供的试剂或电极材料中选择正确的序号填在横线上:
①纯水②NaCl溶液③NaOH溶液④四氯化碳⑤CuCl2溶液⑥乙醇⑦铁棒⑧植物油⑨碳棒
a为 ,b为 ,c为 ,d为 .(填序号)
(2)书写电极反应式:
阳极 ;.阴极 .
(3)c的作用是 .
(4)在加入c之前,对d溶液的简单处理应是 ,这样处理的目的是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com