
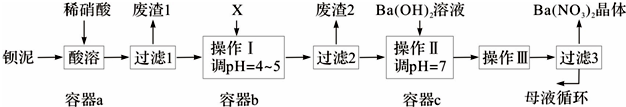
分析 钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在a容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣2为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,
(1)根据化合价代数和为0判断Ba(FeO2)2中Fe的化合价;
(2)根据电离常数判断酸性强弱,根据强酸制弱酸的原理书写反应的离子方程式;
(3)当c(CO32-)×c(Ba2+)>Ksp(BaCO3)时,可实现沉淀的转化;
(4)Ba(FeO2)2与HNO3反应生成Ba(NO3)2和Fe(NO3)3,以此确定反应的化学方程式;
(5)X既要能中和硝酸,又不产生新杂质,结合本厂实际,故可用BaCO3;根据上面的分析可知,废渣2为Fe(OH)3;
(6)通过蒸发浓缩、冷却结晶、过滤,得到硝酸钡晶体,剩余的滤液中仍含有少量的Ba(NO3)2,可循环使用;
(7)根据沉淀硫酸钡的质量,结合方程式计算求出硝酸钡的质量,再求样品的纯度.
解答 解:(1)根据化合价代数和为0可知,Ba(FeO2)2中Fe的化合价为+3价,
故答案为:+3;
(2)根据电离常数可知,酸性强弱为H2CO3>HCl2CO>HCO3-,所以次氯酸钠中通入二氧化碳发生反应的离子方程式为ClO-+CO2+H2O=HClO+HCO3-,
故答案为:ClO-+CO2+H2O=HClO+HCO3-;
(3)将BaCO3加入足量的饱和Na2CO3溶液中,存在BaSO4(s)?Ba2+(aq)+SO42-(aq),钡离子与碳酸根离子结合生成碳酸钡沉淀,使硫酸钡的沉淀溶解平衡正移,从而转化为碳酸钡,其反应的离子方程式为:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq),
故答案为:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq);
(4)Ba(FeO2)2与中钡元素为+2价,铁元素为+3价,所以反应产物为Ba(NO3)2和Fe(NO3)3,所以其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O;
(5)X既要能中和硝酸,又不产生新杂质,结合工厂实际,应该用BaCO3来调节pH,故选③,已知Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7,流程中调节PH为4~5,所以三价铁离子会完全转化为沉淀Fe(OH)3,
故答案为:③;Fe(OH)3;
(6)通过蒸发浓缩、冷却结晶、过滤,得到硝酸钡晶体,剩余的滤液中仍含有少量的Ba(NO3)2,所以含有Ba(NO3)2的母液应该,循环到容器c中,
故答案为:c;
(7)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,其发生的反应为:Ba(NO3)2+H2SO4=BaSO4+2HNO3,
设参加反应的Ba(NO3)2为xg,
Ba(NO3)2+H2SO4=BaSO4+2HNO3
261 233
x mg
则 $\frac{261}{x}$=$\frac{233}{mg}$,解得x=$\frac{261m}{233}$,所以该Ba(NO3)2的纯度为$\frac{\frac{261m}{233}}{w}$×100%=$\frac{261m}{233w}$×100%,
故答案为:$\frac{261m}{233w}$×100%.
点评 本题考查学生在“工艺流程阅读、相关反应化学方程式书写、化学反应条件控制的原理、生产流程的作用”等方面对元素化合物性质及其转化关系的理解和应用程度,考查学生对新信息的处理能力,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
| 试管 | CaCO3的状态 | 盐酸的浓度 | 温度 |
| A | 块状 | 1mol•L-1 | 20℃ |
| B | 粉末状 | 1mol•L-1 | 20℃ |
| C | 块状 | 2mol•L-1 | 40℃ |
| D | 粉末状 | 2mol•L-1 | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu和足量的稀硝酸反应产生4.48 L气体时,转移的电子数为0.6×6.02×1023 | |
| B. | 常温常压下,8.8 g CO2和N2O混合物中所含有的原子总数为0.6×6.02×1023 | |
| C. | 标准状况下,3.36 L己烷中含有的分子数目为0.15×6.02×1023 | |
| D. | 在1 L 0.2 mol/L的硫酸铁溶液中含有的三价铁离子数为0.4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
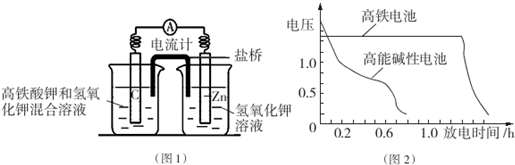
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | |||||||
| 3 | A | C | D | G | ||||
| 4 | B | F |
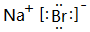 ,高温灼烧该化合物时,火焰呈黄色.
,高温灼烧该化合物时,火焰呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  在新型催化剂作用下利用太阳能使水分解的能量变化曲线 | |
| B. |  KNO3溶解度曲线,α点所示溶液为50℃时的不饱和溶液 | |
| C. |  常温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 | |
| D. |  10ml 0.01ml/L KMnO4酸性溶液与过量的0.1mol/L H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
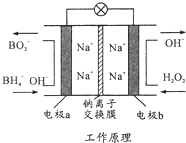 某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为BH4-+8OH--8e-=BO2- | |
| C. | b极上的电极反应式为H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mol e- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com