
| 实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡. | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡 | 溶液出现棕黄色 | ______ |
| 3.______ | 溶液变成蓝色 | ______ |
| 实验步骤 | 实验现象 | 实验结论(步骤2用 离子方程式表示) |
| 2IO3-+5HSO3-═I2+5SO42-+3H++H2O | ||
| 再向上述溶液中滴加淀粉溶液,振荡 | 淀粉遇碘变蓝 |
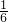 ×0.00010mol,
×0.00010mol,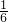 ×0.00010mol×214g/mol=0.00428g=3.57mg,
×0.00010mol×214g/mol=0.00428g=3.57mg,

科目:高中化学 来源: 题型:解答题
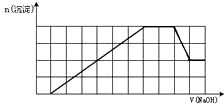 某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,由此可知
某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,由此可知查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com