
| A. | NH4HCO3溶于过量的浓KOH溶液中并加热:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓ | |
| C. | 向FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
分析 A.加热条件下碳酸氢铵与过量氢氧化钾反应生成碳酸钾、氨气和水;
B.硫酸根离子沉淀完全时,铝离子完全转化成偏铝酸钠;
C.氯气少量,碘离子优先被氧化;
D.磁性氧化铁为四氧化三铁,离子方程式中四氧化三铁不能拆开.
解答 解:A.NH4HCO3溶于过量的浓KOH溶液中并加热,反应的离子方程式为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O,故A正确;
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全,铝离子完全转化成偏铝酸根离子,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故B错误;
C.向FeI2溶液中通入少量氯气,亚铁离子的还原性需要碘离子,碘离子优先反应,正确的离子方程式为:2I-+Cl2=I2+2Cl-,故C错误;
D.四氧化三铁不能拆开,正确的离子方程式为:3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故D错误;
故选A.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
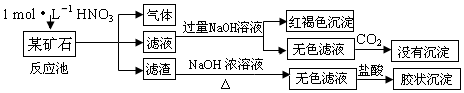
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
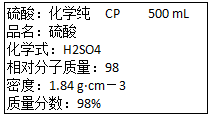 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维勒用无机物合成了尿素,突破了无机物与有机物的界限 | |
| B. | 开发核能、太阳能等新能源,推广乙醇汽油,使用无磷洗涤剂都可直接降低碳排放量 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com