
| 0.6mol |
| 3mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、0.6mol?L-1 |
| B、0.15mol?L-1 |
| C、0.3mol?L-1 |
| D、0.45mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
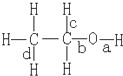 乙醇分子中不同的化学键如图所示,下列不同反应中键的断裂位置分别是:
乙醇分子中不同的化学键如图所示,下列不同反应中键的断裂位置分别是:查看答案和解析>>
科目:高中化学 来源: 题型:
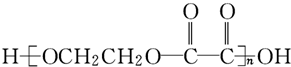 的过程是:
的过程是:| ① |
| ② |
| ③ |
| ④ |
| ⑤ |
| ⑥ |
| ⑦ |
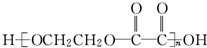
查看答案和解析>>
科目:高中化学 来源: 题型:
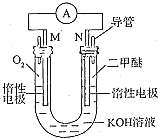 I.二甲醚是一种重要的新型清洁燃料j可替代氟利昂作制冷剂,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
I.二甲醚是一种重要的新型清洁燃料j可替代氟利昂作制冷剂,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
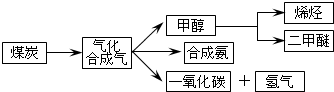
| c(H2)?c(CO) |
| c(H2O) |
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol/L) | 0.8 | 1.24 | 1.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、仅①②③④ | B、仅②③④⑤ |
| C、仅①②④⑥ | D、都有可能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com