

分析 (1)①空气质量报告的主要内容包括:空气污染指数、首要污染物(包括可吸入颗粒物、二氧化硫、二氧化氮等气体)、空气质量级别、空气质量状况等;
②a.废旧电池中含有重金属,能污染水资源和土壤;
b.充分利用太阳能、风能等清洁能源,减少化石燃料的使用;
c.给汽车加装尾气催化净化装置,减少了污染物一氧化碳和一氧化氮的排放;
③沉淀法是利用某些化学物质作沉淀剂,与废水中的污染物发生化学反应,生成难溶于水的沉淀析出,从废水中分离出去;废水中含有酸性物质时,应向废水中加入碱性物质使其发生中和反应,从而降低溶液的酸性;利用氧化还原法将废水中的有害物质转变为无毒物质、难溶物质或易除去的物质;
(2)①根据常见微量元素有碘、铁、氟、锌;
②a.氨基酸不是药;
b.阿斯匹林具有解热镇痛作用;
c.青霉素是一种抗生素,能杀死某些致病细菌;
③根据蛋白质水解生成氨基酸;柠檬黄、胭脂红、胡萝卜素等是常用的着色剂;根据苯甲酸钠、山梨酸钾是常用的防腐剂;
(3)①生产玻璃的原料是纯碱、石灰石和石英;生产水泥的原料是粘土和石灰石;加入氧化钴可制得蓝色玻璃;根据质量守恒定律书写方程式;
②金属的腐蚀主要是电化学腐蚀中的吸氧腐蚀,形成原电池后,负极金属腐蚀速率加快;合金的硬度比成分金属大,熔点比成分金属低;
③天然橡胶通过硫化措施可增大强度和弹性;
解答 解:(1)①空气质量报告的主要内容包括:空气污染指数、首要污染物(包括可吸入颗粒物、二氧化硫、二氧化氮等气体)、空气质量级别、空气质量状况等,不需要检测二氧化碳的浓度,
故选a;
②a.废旧电池中含有重金属,进行深埋处理 能污染水资源和土壤,应回收处理,故a错误;
b.充分利用风能等新能源,减少了化石燃料的使用,有利于改善环境质量,故b正确;
c.给汽车加装尾气催化净化装置,减少了污染物一氧化碳和一氧化氮的排放,有利于改善环境质量,故c正确;
故选a;
③废水中含有盐酸,盐酸易溶于水,盐酸溶液呈酸性,所以要在废水中加入碱性物质,使其发生酸碱中和反应而降低废水的酸性,所以采用的处理方法是中和法,
故选b;
(2)①在氢、钠、铁这三种元素中,属于人体生命活动必需微量元素是铁,故答案为:铁;
②a.氨基酸不是药,故a错误;
b.阿斯匹林是感冒药,具有解热镇痛作用,故b错误;
c.青霉素是一种抗生素,能杀死某些致病细菌,故c正确;
故选:c;
③根据鸡肉粉中含有蛋白质,蛋白质水解生成氨基酸,姜黄是着色剂;苯甲酸钠是防腐剂;
故答案为:鸡肉粉;姜黄;苯甲酸钠;
(3)①生产玻璃的原料是纯碱、石灰石和石英;生产水泥的原料是粘土和石灰石,所以生产水泥和玻璃都用到的原料是石灰石;蓝色玻璃是在其中添加了氧化钴(Co2O3)的缘故;工业上用石英砂与焦炭高温下条件下生成SiC同时生成CO,方程式为:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑;
故答案为:石灰石;Co2O3;SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑;
②钢铁的腐蚀主要是电化学腐蚀中的吸氧腐蚀,沿海地区潮湿的空气中含大量NaCl电解质,这样会形成原电池,铁为负极,会加快了金属腐蚀;和纯铝相比,硬铝的强度高;
故答案为:电化学;高;
③天然橡胶通过硫化措施可增大强度和弹性;
故答案为:硫化;
点评 本题主要考查了化学与生活中的知识,涉及内容较多,平时注意基础知识的积累,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 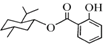 的分子式为C17H24O3 的分子式为C17H24O3 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙炔 | |
| C. | 有机硅聚醚( )可由单体 )可由单体 和 和 缩聚而成 缩聚而成 | |
| D. | 等质量的甲醇、甲醛、甲醚完全燃烧时的耗氧量依次递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的正戊烷所含的分子数为0.5NA | |
| B. | 1 mol甲基中的电子数目为9NA | |
| C. | 28g乙烯所含共用电子对数目为4NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32gO2所含的氧原子数目为NA | |
| B. | 标准状况下,22.4L水中所含的水分子数目为NA | |
| C. | 1mol•L-1Na2SO4溶液中含有的钠离子数目为2NA | |
| D. | 1molMg变为Mg2+时失去电子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 1,2一二氯乙烯有如图两种结构.
1,2一二氯乙烯有如图两种结构.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com