
分析 五种短周期元素A、B、C、D、E的原子序数依次增大.A和B、D、E均能形成共价型化合物,A和B形成的共价化合物在水中呈碱性,该化合物为NH3,则A为H元素、B为N元素,B和D同族,可知D为P;A和C同族,C离子和B离子具有相同的电子层结构,其中只有C为金属元素,可知C为Na元素;C和E形成的化合物在水中呈中性,则E为Cl元素,然后结合元素周期律及元素化合物知识来解答.
解答 解:五种短周期元素A、B、C、D、E的原子序数依次增大.A和B、D、E均能形成共价型化合物,A和B形成的共价化合物在水中呈碱性,该化合物为NH3,则A为H元素、B为N元素,B和D同族,可知D为P;A和C同族,C离子和B离子具有相同的电子层结构,其中只有C为金属元素,可知C为Na元素;C和E形成的化合物在水中呈中性,则E为Cl元素,
(1)五种元素中,原子半径最大的是Na,非金属性最强的是Cl,故答案为:Na;Cl;
(2)非金属性越强,氢化物越稳定,则由A和B、D、E所形成的共价型化合物中,热稳定性最差的是PH3,故答案为:PH3;
(3)D为P,在周期表的位置为第三周期ⅤA族,故答案为:第三周期ⅤA族;
(4)A和B形成的化合物与A和E形成的化合物反应,产物的化学式为NH4Cl,该化合物溶于水,水解显 酸性,原因是NH4++H2O?NH3.H2O+H+,
故答案为:NH4Cl;酸;NH4++H2O?NH3.H2O+H+;
(5)D和E可形成PCl3,由电子式 可知所有原子都满足8电子结构的化合物,故答案为:PCl3.
可知所有原子都满足8电子结构的化合物,故答案为:PCl3.
点评 本题考查位置、结构及性质的综合应用,为高频考点,把握元素的位置、元素的性质推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识及周期律的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
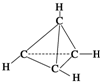 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )| A. | 2 种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可用作食品干燥剂 | B. | 乙醇可作消毒剂 | ||
| C. | 氢氧化铝可作胃酸中和剂 | D. | 二氧化碳可作钠着火的灭火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①③④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径的大小顺序为:r(R2-)>r(X+)>r(Y2-) | |
| B. | 最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| C. | Y与X形成的化合物和Y与W形成的化合物化学键类型完全相同 | |
| D. | 分别向BaCl2溶液中通入RY2、WY2,均有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ⑤ | C. | ③⑤ | D. | ④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com