
| A、原子半径:B>C>D>A |
| B、单质B制作的容器可用来盛放浓硝酸 |
| C、A、C形成的物质属于两性氧化物 |
| D、元素D在周期表中位于第三周期、VIIA族 |


科目:高中化学 来源: 题型:
| A、加酸或碱一定抑制水的电离 |
| B、加盐一定促进水的电离 |
| C、升高温度,水的pH值变小 |
| D、常温下任何稀的酸、碱、盐水溶液中KW=10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:SiI4<SiBr4<SiCl4<SiF4 |
| B、沸点:H2S>H2O>HF>NH3 |
| C、熔点:金刚石>晶体硅>晶体锗>硫 |
| D、硬度:金刚石>白磷>冰>水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
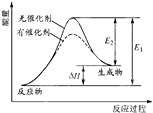 某反应的反应过程中能量的变化如图所示,图中E1表示正反应的活化能,E2表示逆反应的活化能,下列有关叙述正确的是( )
某反应的反应过程中能量的变化如图所示,图中E1表示正反应的活化能,E2表示逆反应的活化能,下列有关叙述正确的是( )| A、该反应为放热反应 |
| B、催化剂能改变该反应的焓变 |
| C、E1也可表示反应物断键需要吸收的总能量 |
| D、△H=E2-E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 标准状况,体积相同的四支试管中分别盛满Cl2、NH3、SO2和NO2,分别倒立在盛有足量水的水槽中(假设进入试管的液体不扩散),光照充分溶解.
标准状况,体积相同的四支试管中分别盛满Cl2、NH3、SO2和NO2,分别倒立在盛有足量水的水槽中(假设进入试管的液体不扩散),光照充分溶解.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性 HClO4>HBrO4>HIO4 |
| B、碱性 Ba(OH)2>Ca(OH)2>Mg(OH)2 |
| C、稳定性 HCl>H2S>PH3 |
| D、氧化性 I>Br>Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加催化剂,V正、V逆 都发生变化,且变化的倍数相等 |
| B、加压,V正、V逆 都增大,且V正 增大的倍数大于V逆增大的倍数 |
| C、降温,V正、V逆 都减小,且V正 减小的倍数大于V逆减小的倍数 |
| D、增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数;N2 转换率减小,H2转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com