
分析 (1)制备氢氧化铁胶体的方法:向25ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热;
(2)只有胶体具有丁达尔效应,可以验证胶体的产生;
(3)胶体的电泳实验证明了胶体胶粒是带电的;加入稀硫酸,胶体先发生聚沉,氢氧化铁沉淀和稀硫酸进一步发生中和反应.
解答 解:(1)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,反应的化学方程式为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3HCl,其它做法都不能生成胶体,往往得到沉淀,
故答案为:丙;FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3HCl;
(2)胶体具有丁达尔效应,当用激光笔照射时,会有一道明亮的光路,
故答案为:用激光笔照射,有一条明亮的光路,则有胶体生成;
(3)①Fe(OH)3胶粒带正电,通电时带正电荷的粒子向阴极移动,阴极附的颜色逐渐变深,
故答案为:Fe(OH)3胶粒带正电;
②向氢氧化铁胶体中逐滴加入过量H2SO4溶液,H2SO4电离出的SO42-使Fe(OH)3胶体发生聚沉,H+使Fe(OH)3沉淀溶解,会观察到先出现红褐色沉淀,后沉淀消失,方程式为2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O,
故答案为:先生成红褐色的沉淀,后溶解为黄色溶液;2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O.
点评 本题考查胶体的制备以及性质探究,为高频考点,侧重考查学生的分析能力和实验能力,题目难度不大,易错点为胶体的制备,注意制备方法.本题重点把握胶体的聚沉的性质.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
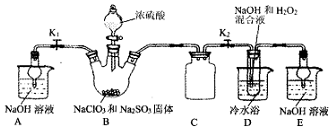
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
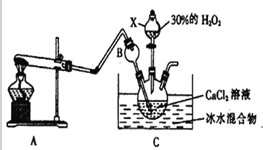
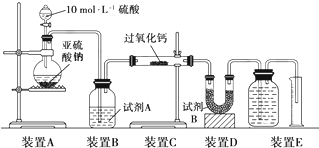
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的电子式: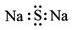 | B. | 中子数为10的氧原子:${\;}_8^{10}O$ | ||
| C. | 硫离子的结构示意图: | D. | HC1O的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑦ | C. | ③⑤⑥ | D. | ③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅含有共价键的物质定是共价化合物 | |
| B. | 单质分子中均存在化学键 | |
| C. | 离子化合物中一定含有离子键,可能含有配位键和共价键 | |
| D. | 由不同种非属元素的原子形成的共价化合物一定只含极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥⑦ | B. | ③⑤ | C. | ①②④⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. | CH3-CH2-CH=CH2 3-丁烯 | ||
| C. | 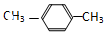 ,对二甲苯 ,对二甲苯 | D. | 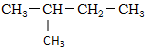 ,3-甲基丁烷 ,3-甲基丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com