
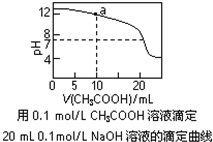
| A. | pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | 图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
分析 A.pH相同的钠盐溶液中,弱根离子水解程度越大,其盐溶液浓度越小,碳酸钠的水解程度大于碳酸氢钠,大于醋酸钠;
B.根据物料守恒得c(Na+)=c(A2-)+c(HA-)+c(H2A);
C.pH=7时c(OH-)=c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),综合分析;
D.a点溶液中存在的溶质是等物质的量的醋酸钠和氢氧化钠,根据物料守恒得c(Na+)=2c(CH3COO-)+2c(CH3COOH),根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以得c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH).
解答 解:A.pH相同的钠盐溶液中,弱根离子水解程度越大,其盐溶液浓度越小,碳酸钠的水解程度大于碳酸氢钠,大于醋酸钠,则当三种溶液的pH相同时,其物质的量浓度由大到小的顺序是③<②<①,钠离子浓度大小顺序是③<②<①,故A错误;
B.根据物料守恒得c(Na+)=c(A2-)+c(HA-)+c(H2A),故B错误;
C.pH=7时c(OH-)=c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以得c(Na+)=c(CH3COO-),故C错误;
D.a点溶液中存在的溶质是等物质的量的醋酸钠和氢氧化钠,根据物料守恒得c(Na+)=2c(CH3COO-)+2c(CH3COOH),根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以得c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故D正确;
故选D.
点评 本题结合弱酸盐的水解程度来比较离子浓度的大小,学生在解题时要学会应用守恒的思想综合分析解题,题目难度较大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 .②的氢化物含有化学键的类型是共价键,与②的氢化物分子所含电子总数相等的分子是H2O(举一例、填化学式,下同)、离子是OH-.
.②的氢化物含有化学键的类型是共价键,与②的氢化物分子所含电子总数相等的分子是H2O(举一例、填化学式,下同)、离子是OH-.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3 溶液中加入等物质的量浓度等体积的澄清石灰水:HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| B. | Ca(ClO)2 溶液中加入Na2SO3 溶液 Ca2++SO32-═CaSO3↓ | |
| C. | 食醋溶解蛋壳:CaCO3+2CH3COOH═Ca2++CO2↑+H2O+2CH3COO- | |
| D. | 将少量CO2气体通入 溶液中:CO2+H2O+ 溶液中:CO2+H2O+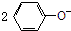 → → +CO32- +CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:SiO2>CsCl>CCl4>CF4 | |
| B. | 离子半径:F->O2->Al3+>Na+ | |
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO3<HNO3 | |
| D. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2010年11月12日至27日,中国广州成功举办了第16届亚运会,中国代表团共获得了199枚金牌.为保证比赛成绩的公正、公平,反兴奋剂是一项重要而艰巨的工作.某种兴奋剂的结构简式如图所示.有关该物质的说法错误的是( )
2010年11月12日至27日,中国广州成功举办了第16届亚运会,中国代表团共获得了199枚金牌.为保证比赛成绩的公正、公平,反兴奋剂是一项重要而艰巨的工作.某种兴奋剂的结构简式如图所示.有关该物质的说法错误的是( )| A. | 该有机物能与FeCl3溶液发生显色反应 | |
| B. | 一定条件下1mol该物质能与7molH2发生加成反应 | |
| C. | 该有机物分子中所有的原子不可能在同一平面 | |
| D. | 该有机物是苯酚的同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com