
将V1ml1.0mol·L-1HCl溶液和V2ml未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+ V2=50ml)。下列叙述正确的是( )
V2=50ml)。下列叙述正确的是( )
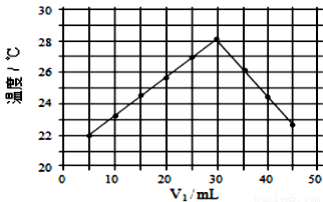
A. 做该实验时环境温度为22℃
B. 该实验表明热能可转化为化学能
C. NaOH溶液的浓度约为1.5mol·L-1
D. 该实验表明有水生成的反应都是放热反应
科目:高中化学 来源: 题型:填空题
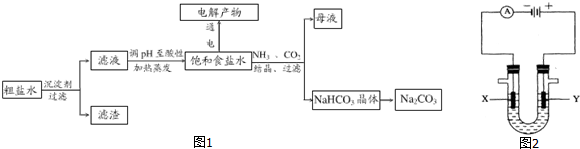
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04 mol•L-1 | B. | 0.5 mol•L-1 | C. | 0.05 mol•L-1 | D. | 0.04 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;  ;
; 
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:填空题
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 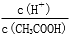 的比值将____________(填“增大”、“减小”或“无法确定”)。
的比值将____________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)___ _______pH(乙)(填“大于”、“小于”或“等于”,下同)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
某温度下,2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g) 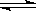 3Z(g)平衡时X、Y、Z的体积分数分别为30%、60%、10%.在此平衡体系中又加入1molZ(g),再达平衡后,X、Y、Z的体积分数不
3Z(g)平衡时X、Y、Z的体积分数分别为30%、60%、10%.在此平衡体系中又加入1molZ(g),再达平衡后,X、Y、Z的体积分数不 变。下列不正确的是( )
变。下列不正确的是( )
A.m=2 B.第二次平衡时,Z的浓度为0.2mol•L﹣1
C.又加入1molZ,平衡没有发生移动 D.两次平衡的平衡常数相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
下列能源的大量使用会导致全球进一步变暖、雾霾天气增多的是( )
A.地热能 B.太阳能 C.氢能 D.化石能源
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
已知:H2O(g)=H2O(l)ΔH=Q1kJ·mol-1
C2H5OH(g)=C2H5OH(l)ΔH=Q2kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)ΔH=Q3kJ·mol-1
若使46g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
A.(Q1+Q2+Q3) kJ B.0.5(Q+Q2+Q3) kJ
C.(0.5Q1-1.5Q2+0.5Q3) kJ D.(Q2-3Q1-Q3)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
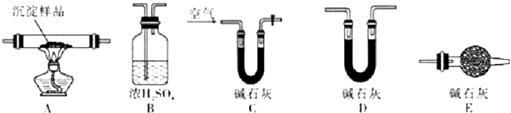
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com