
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  检验铁粉与水蒸气反应产生的氢气 | |
| B. |  快速制备和收集一定量的氨气 | |
| C. |  分离互溶但沸点相差较大的液体混合物 | |
| D. | 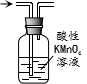 除去甲烷中少量的乙烯得纯净甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CH+H2O $→_{△}^{HgSO_{4}}$CH3CHO | |
| B. | C2H5Br+H2O $→_{△}^{NaOH}$ C2H5OH+HBr | |
| C. | CaC2+2H2O→Ca(OH)2+C2H2↑ | |
| D. | CH3COOCH3+H2O$→_{△}^{催化剂}$CH3COOH+CH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | 开始沉淀 | 沉淀完全 |
| Zn2+ | 5.7 | 6.2 |
| Mn2+ | 8.2 | 9.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com