
| ||
| O | 2- 4 |
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、1mol氧单质一定含有2NA个氧原子 |
| B、含4mol C-O键的二氧化碳分子中含氧原子数为4NA |
| C、6.8g液态KHSO4中含有0.05NA个阳离子 |
| D、1molH3O+中含质子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
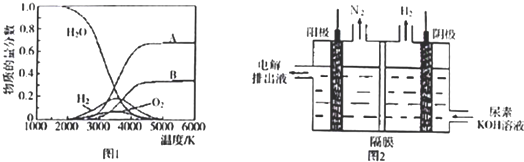
查看答案和解析>>
科目:高中化学 来源: 题型:
 近年来,化学工作者在CO2的应用研究上取得了一些重要成果.
近年来,化学工作者在CO2的应用研究上取得了一些重要成果.| 3 |
| 2 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 已知 | 类推 | |||||||||
| A | 将Fe加入CuSO4溶液中:Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+ | ||||||||
| B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性:2H++SO42-+Ba++2OH-=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性:2H++SO42-+Ba++2OH-=BaSO4↓+2H2O | ||||||||
| C | 铁和氯气反应2Fe+3Cl2
|
铁和单质反应2Fe+3I2
| ||||||||
| D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、上述反应中涉及的氧化还原反应共有3个 |
| B、氧化性:Cl2>NaBi03>Bi205>Bi203? |
| C、生成NaBi03的反应中,NaBi03的化学计量数为2 |
| D、得到0.05molBi203时,上述过程中共转移电子0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、反应①②都是氧化还原反应 |
| B、反应②是置换反应 |
| C、反应①中Ti02:是氧化剂 |
| D、反应②中每生成1mol Ti转移4 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将浓度为0.1mol?L-1 HF溶液加水不断稀释过程中,c( H+) 和c ( OH-)都会减小 |
| B、为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的PH.若PH>7,则H2A是弱酸;若PH<7,则H2A是强酸 |
| C、将SO2通入一定量KOH溶液,所得溶液呈中性,该溶液中一定含KHSO3 |
| D、用0.200mol?L-1 NaOH标准溶液滴定浓度均为0.1mol?L-1 的HCl与CH3COOH的混合液,至中性时,溶液中的酸恰好被完全中和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com