
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀HNO3中加入过量铁粉,再滴入少量KSCN溶液 | 溶液变红 | 稀HNO3将Fe氧化为Fe3+ |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.向稀HNO3中加入过量铁粉,生成硝酸亚铁;
B.向AgNO3溶液中滴加过量氨水,生成银氨络离子;
C.稀硝酸与铜反应生成硝酸铜和NO;
D.下层溶液显紫红色,说明有碘生成.
解答 解:A.向稀HNO3中加入过量铁粉,生成硝酸亚铁,加入KSCN,溶液不变红色,故A错误;
B.向AgNO3溶液中滴加过量氨水,生成银氨络离子,则Ag+与NH3•H2O不能大量共存,故B错误;
C.稀硝酸与铜反应生成硝酸铜和NO,没有单质生成,不是置换反应,故C错误;
D.下层溶液显紫红色,说明有碘生成,可说明氧化性:Fe3+>I2,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、离子的检验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
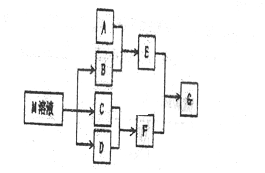
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能够使溴水褪色,是因为乙烯和溴水反应生成了2-溴乙烷 | |
| B. | 将红热的铜丝插入到1-丙醇中,可以制得丙酮 | |
| C. | 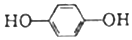 和苯酚互为同系物 和苯酚互为同系物 | |
| D. | 分子式为C10H12具有两个邻位链烃取代基的芳香烃有4种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
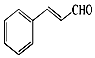 自然界中的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用.桂皮中含有肉桂醛,结构如图,杏仁中含有苯甲醛.以下说法错误的是( )
自然界中的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用.桂皮中含有肉桂醛,结构如图,杏仁中含有苯甲醛.以下说法错误的是( )| A. | 肉桂醛分子中含有两种官能团,分子式为C9H8O | |
| B. | 肉桂醛分子中最多有18个原子共平面 | |
| C. | 1 mol肉桂醛与氢气加成时最多消耗4 mol H2 | |
| D. | 肉桂醛与苯甲醛不是同系物,但都能发生氧化反应和还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 只能利用焰色反应可鉴别KCl溶液和Na2SO4溶液 | |
| C. | 用水润湿pH试纸测量某溶液的PH | |
| D. | 实验室用NaOH溶液除去Cl2中的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1NH4Cl溶液中,NH4+的数量为0.1NA | |
| B. | 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA | |
| C. | 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA | |
| D. | 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com