
| 实验序号 | 反应温度(℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
分析 (1)根据温度和浓度对化学反应速率的影响分析;
(2)当分析某一因素对化学反应速率的影响时,其它物理量要相同;
(3)根据二氧化硫的性质或实验装置分析不利因素.
解答 解:(1)温度越高,反应速率越快,浓度越大反应速率越快,在上述实验中反应速率最快的可能是D,
故答案为:D;
(2)①能说明温度对该反应速率影响的组合中两者的温度不同,其它物理量相同,故选BD,
故答案为:BD;
②A和B、A和C的组合中不同的物理量是浓度,所以比较所研究的问题是相同温度条件下浓度对该反应速率的影响,
故答案为:浓度;AC;
③B和C的组合不同点是:硫代硫酸钠和硫酸的浓度不同,所以比较所研究的问题是相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度,
故答案为:相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度;
(3)二氧化硫可以溶于水,1体积水能溶解40体积二氧化硫,所以导致测定不精确,且该实验装置较复杂,不易控制,所以不采用排水法测量单位时间内气体体积的大小进行比较,
故答案为:SO2可溶于水,测定不精确或实验装置较复杂,不易控制.
点评 不同考查探究影响化学反应速率的因素,做对比实验时,只有改变一个条件,其它物理量相同才能得出正确结论,难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| B. | 碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污 | |
| C. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
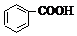 >H2CO3>
>H2CO3> >HCO3-,向Na2CO3溶液中逐滴加入水杨酸(
>HCO3-,向Na2CO3溶液中逐滴加入水杨酸( )溶液,可能发生的反应的离子方程式书写正确的是( )
)溶液,可能发生的反应的离子方程式书写正确的是( )| A. | 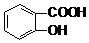 +CO32-→ +CO32-→ +HCO3- +HCO3- | B. |  +CO32-→ +CO32-→ +H2O+CO2↑ +H2O+CO2↑ | ||
| C. | 2 +CO32-→2 +CO32-→2 +CO2↑ +CO2↑ | D. | 3 +2CO32-→3 +2CO32-→3 +HCO3-+H2O+CO2↑ +HCO3-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在两支小试管中分别加入5mL 盐酸和5mL硫酸,再分别放入一段大小相同且纯度>99.5%铝片,实验现象如表所示.
在两支小试管中分别加入5mL 盐酸和5mL硫酸,再分别放入一段大小相同且纯度>99.5%铝片,实验现象如表所示. | 1min | 6min | 8min | 20min | |
| 3mol?L-1盐酸 | 少量 气泡 | 较多 气泡 | 大量气泡,出现灰色物质 | 气泡消失,溶液澄清透明 |
| 1.5mol?L-1 硫酸 | 无明显现象(无气泡) | |||
| 实验方案 | 现象 | 实验结论 | ||
| A | 3mol•L-1盐酸 | / | 产生较多气泡 | / |
| B | 3mol•L-1盐酸 | Na2SO4晶体少量 | 与A无明显差异 | 假设一:不成立. (填“成立”、“不成立”) |
| C | 1.5mol•L-1硫酸 | NaCl晶体少量 | 与A无明显差异 | |
| D | 3mol•L-1盐酸 | NaCl晶体少量 | 与A无明显差异 |
| E | 1.5mol•L-1硫酸 | 无现象 | ||
| F | 1.5mol•L-1硫酸 | 铝片用砂纸打磨 | 少量气泡后停止 | 假设二:成立. (填“成立”、“不成立”) |
| G | 1.5mol•L-1硫酸 | 铝片用食盐水泡1天再取出清洗 | 少量气泡后停止 | |
| H | 1.5mol•L-1硫酸 | 铝片插入Hg(NO3)2溶液再取出清洗 | 表面有较多气泡 | |
| I | 1.5mol•L-1硫酸 | 铝片插入Cu(NO3)2溶液再取出清洗 | 无气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,B的结构简式
,B的结构简式 或
或 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、C:CH3COOH
、C:CH3COOH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cl-、K+、SO42- | B. | Fe3+、Al3+、SO42-、NH4+ | ||
| C. | NH4+、SO42-、Mg2+、Cl- | D. | S2-、Na+、HCO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列命名正确的是( )
,下列命名正确的是( )| A. | 2,4-二甲基-3-乙基己烷 | B. | 3-异丙基-4-甲基已烷 | ||
| C. | 2-甲基-3,4-二乙基戊烷 | D. | 3-甲基-4-异丙基已烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com