
【题目】下列说法正确的是
A.HCl属于共价化合物,溶于水能电离出H+和Clˉ
B.NaOH是离子化合物,该物质中只含有离子键
C.HI气体受热分解的过程中,只需克服分子间作用力
D.石英和干冰均由原子构成
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为验证SO2的还原性,特邀你参与以下探究活动。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的分析,你认为可能观察到的现象是:_____________,你预测的理论依据是(用离子方程式表示):________________________。
II.实验探究
(1)配制1mol/LFeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:_______________。
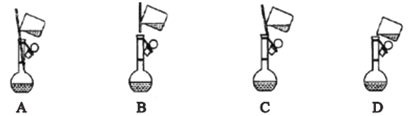
②测溶液的pH得知溶液呈酸性,其原因是:____________________ (用离子方程式表示)。
(2)SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:_______________。
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。
请你推测小组在实验方案设计中“加浓HC1酸化”的目的是:_______________。
III.感悟与分享
通过探究,小组同学深受启发、感悟良多。比如,有同学认为“实验才是化学的最高法庭”。请写出一种你的感悟与同学分享:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 氯水中有平衡:Cl2+H2O![]() HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B. 对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 对2NO2(g)![]() N2O4(g) △H<0, 升高温度平衡体系颜色变深
N2O4(g) △H<0, 升高温度平衡体系颜色变深
D. SO2催化氧化成SO3的反应,往往加入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如下所示,它在一定条件下可能发生的反应有( )

①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
A. ②③④ B. ①③④⑤⑥
C. ①③④⑤ D. ①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用材料
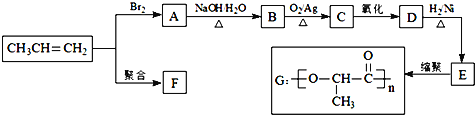
(1)E中官能团的名称_________.
(2)写出D的结构简式_________.
(3)聚合物F的结构简式是____________________.
(4)B转化为C的化学方程式是______________________________.
(5)在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是_________.
(6)E有多种同分异构体,写出与E含有相同官能团的同分异构体的结构简式_________,其核磁共振氢谱显示为__________组峰,峰面积之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() (x)、
(x)、![]() (y)、
(y)、![]() (z) 互为同分异构体,下列说法不正确的是( )
(z) 互为同分异构体,下列说法不正确的是( )
A. Z的二氯代物只有三种
B. x、y、z中只有x的所有原了可能处于同一平面
C. x、y可使溴的四氯化碳溶液因发生加成反应而褪色
D. x的同分异构体只有y和z两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G。流程如图所示
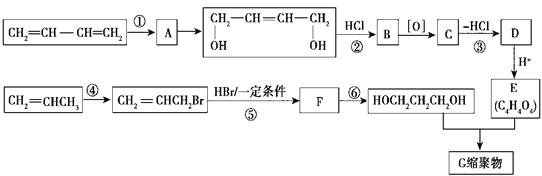
请完成下列各题:
(1)反应①发生的反应类型是 _________________。
(2)反应③发生的反应条件是 __________________。
(3)反应②、③的目的是 ________________________________________。
(4)写出反应⑤的化学方程式 ____________________________________________。
(5) B被氧化成C的过程中会有中间产物生成,该中间产物可能是 __________________(写出一种物质的结构简式),检验该物质存在的试剂是 _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修 3:物质结构与性质]
(1) 过渡金属元素铁能形成多种配合物,如:[Fe (CN) 6] 4-、[Fe(SCN)6]3-等。
Fe3+的核外电子排布式为______________,从原子结构的角度解释Fe3+比Fe2+稳定的理由是_______________。
(2) N的基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3) (NH4)2SO4阴离子的立体构型是________,NH4+中心原子的杂化类型是________。
(4) Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:
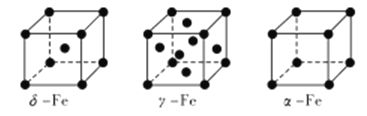
① δ、α两种晶体晶胞中铁原子的配位数之比为_____________。
②1个γ晶体晶胞中所含有的铁原子数为_____________。
③若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为____________g/cm3(列出算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com