
| A. | 该反应中维生素C作还原剂 | |
| B. | 河虾与其它含维生素C较多蔬菜也不宜同食 | |
| C. | 河虾与西红柿同食发生了氧化还原反应 | |
| D. | 该反应中砷元素被氧化 |
分析 根据河虾中含有五价砷与维生素C反应生成有毒的3价砷,则河虾中的含砷物质为氧化剂,维生素C为还原剂;含有3价砷的物质有毒,五价砷的物质无毒.
解答 解:A.由信息可知,反应中砷元素的化合价降低,则维生素C中某元素的化合价升高,则维生素C在反应中作还原剂,故A正确;
B.河虾与其它含维生素C较多蔬菜同食会生成有毒的+3价砷,所以不能同食,故B正确;
C.河反应中砷元素的化合价降低,维生素C中某元素的化合价升高,所以发生了氧化还原反应,故C正确;
D.反应中砷元素的化合价降低,该反应中砷元素被还原,故D错误.
故选D.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3 04 | B. | CuO | C. | HgS | D. | FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
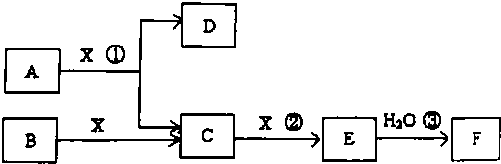
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| 1 | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| 2 | Cl2、FeBr2 | FeCl3、FeBr3 |
| 3 | MnO4-、Cl-… | Cl2、Mn2+… |
| A. | 第①组反应的其余产物为H20 | |
| B. | 第②组反应中CI2与FeBr2的物质的量之比小于或等于1:2 | |
| C. | 第③组反应中生成1mol Cl2,转移电子5 mol | |
| D. | 氧化性由强到弱顺序为Mn04->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | R | D |
| 相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期I B族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
| 键能(kJ/mol) | 熔点(K) | 沸点(K) | |
| BO2 | B-O:452 | 1923 | 2503 |
| DO2 | D=O:615,D-O:348 | 216 | 195 |
 ,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$.
,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$. ( AH3配体作为一个整体写).
( AH3配体作为一个整体写).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCl2完全溶于水时转移的电子数为NA | |
| B. | 1mol羟基(-OH)含有的电子数为9NA | |
| C. | 100g30%醋酸溶液中氢原子数为2NA | |
| D. | 100mL水中OH-的个数是10-8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com