
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
分析 (1)水是弱电解质,存在电离平衡,电离吸热;
(2)硫酸钠溶液是显中性的,c(OH-)=10-7 mol/L;
(3)t2温度下水的离子积常数是1×10-12;根据c(H+)=$\frac{c({H}^{+})×{V}_{1}-c(O{H}^{-})×{V}_{2}}{{V}_{1}+{V}_{2}}$计算.
解答 解:(1))水是弱电解质,存在电离平衡,电离吸热.所以温度升高,水的电离程度增大,离子积增大,
故答案为:>;温度升高,水的电离程度增大,离子积增大;
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1.
故答案为:1000:1;
(3)t2温度下水的离子积常数是1×10-12,所以在该温度下,pH=6是显中性的.因此某溶液pH=7,该溶液显碱性;
所得混合溶液的pH=2,说明稀硫酸过量.所以有c(H+)=$\frac{c({H}^{+})×{V}_{1}-c(O{H}^{-})×{V}_{2}}{{V}_{1}+{V}_{2}}$=$\frac{0.1×b-0.01a}{a+b}$=0.01,解得V1:V2=9:11,
故答案为:碱;9:11.
点评 本题考查考查水的电离、水的离子积常数和pH的有关计算,题目难度中等,注意水的离子积常数与温度有关.


科目:高中化学 来源: 题型:选择题
| A. | 原子核内质子数为19 | B. | 原子核外电子数为19 | ||
| C. | 质量数为40 | D. | 中子数为40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g | B. | 32g | C. | 126g | D. | 142g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
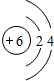 ,元素C在周期表中的位置为第三周期ⅣA族,E的元素名称为氯.
,元素C在周期表中的位置为第三周期ⅣA族,E的元素名称为氯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
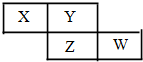 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )| A. | 氢化物的熔、沸点:H2Y>H2Z | |
| B. | 元素X、Z的最高价氧化物对应的水化物都是强酸 | |
| C. | W元素的阴离子与Ar原子具有相同的电子层结构 | |
| D. | X与Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
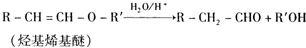
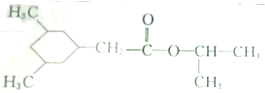 )的线路如下:
)的线路如下: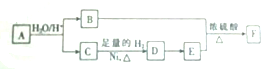
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种意见都支持上述反应为氧化还原反应,且电子转移数相同 | |
| B. | 通过闻生成气体气味可判断反应快慢 | |
| C. | 用稀硫酸可鉴别硫代硫酸钠、亚硫酸钠溶液 | |
| D. | 生成的气体可漂白酸性高锰酸钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com