
| A. | X可以和氢氟酸反应 | |
| B. | 甲烷的稳定性比Y强 | |
| C. | Z是将太阳能转换为电能的常用材料 | |
| D. | 上述①②③变化过程中,依次发生置换反应、复分解反应和分解反应 |
分析 常见的半导体材料为Si,X为Z的氧化物,那么X为二氧化硅;Y为氢化物,且分子结构与甲烷相似,那么Y为硅烷,结构简式为:SiH4,据此解答.
解答 解:常见的半导体材料为Si,X为Z的氧化物,那么X为二氧化硅;Y为氢化物,且分子结构与甲烷相似,那么Y为硅烷,结构简式为:SiH4,
A.二氧化硅能够与氢氟酸反应生成四氟化硅和水,故A正确;
B.碳的非金属性强于硅,所以甲烷的稳定性强于硅烷,故B正确;
C.Z为硅,是良好的半导体材料,将太阳能转换为电能的常用材料,故C正确;
D.①SiO2+4Mg$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+Mg2Si,不属于置换反应,故D错误;
故选:D.
点评 本题为无机推断题,明确硅及其化合物性质是解题关键,题目难度不大,注意硅、二氧化硅用途区别


科目:高中化学 来源: 题型:实验题
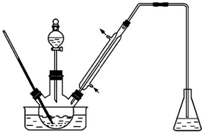 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置如图,相关物质的沸点见附表).
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置如图,相关物质的沸点见附表).| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- | |
| C. | $\frac{{k}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ba2+、Cl-、NO3- | |
| D. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱性溶液中:Na+、K+、Cl-、HCO3- | |
| B. | “84”消毒液中:SiO32-、CO32-、Na+、S2- | |
| C. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭做净化剂去除冰箱中异味 | |
| B. | Fe2O3俗称铁红,常用作红色油漆和涂料 | |
| C. | 推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 | |
| D. | 在食品袋中放入盛有CaCl2•6H2O和铁粉的透气小袋,可防止食物受潮、氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com