
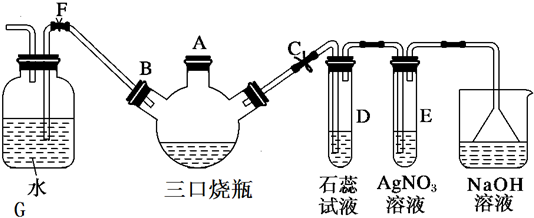

分析 关闭F夹,打开C夹,向装有少量苯的三口烧瓶的A口加少量溴,再加入少量铁屑,塞住A口,三口烧瓶中Fe和溴反应生成溴化铁,在溴化铁作催化剂条件下苯和溴发生取代反应生成溴苯,同时还生成HBr,HBr水溶液呈酸性,能使石蕊试液变红色,溴具有挥发性,溴和水反应生成的HBr和硝酸银反应生成AgBr淡黄色沉淀,溴能和NaOH反应生成无毒物质.
(1)在溴化铁作催化剂条件下,苯和溴发生取代反应生成溴苯;
(2)生成的HBr遇水产生雾,石蕊试液遇酸变红色;溴离子和银离子反应生成淡黄色沉淀;
(3)HBr极易溶于水而产生倒吸现象,互不相溶的液体混合时分层;
(4)挥发出的溴和生成的HBr都能和硝酸银反应生成淡黄色沉淀,要证明发生了取代反应,应该先除去挥发的溴然后用硝酸银检验HBr;
(5)三口烧瓶中的溴苯和未反应的溴、苯互溶,用水除去生成的HBr,用NaOH溶液除去
未反应的溴,用水除去溴化钠,然后干燥剂干燥除去水分,最后用蒸馏方法得到较纯净的溴苯.
解答 解:关闭F夹,打开C夹,向装有少量苯的三口烧瓶的A口加少量溴,再加入少量铁屑,塞住A口,三口烧瓶中Fe和溴反应生成溴化铁,在溴化铁作催化剂条件下苯和溴发生取代反应生成溴苯,同时还生成HBr,HBr水溶液呈酸性,能使石蕊试液变红色,溴具有挥发性,溴和水反应生成的HBr和硝酸银反应生成AgBr淡黄色沉淀,溴能和NaOH反应生成无毒物质.
(1)在溴化铁作催化剂条件下,苯和溴发生取代反应生成溴苯,反应方程式为 ,
,
故答案为: ;
;
(2)生成的HBr遇到水生成氢溴酸小液滴而产生白雾,石蕊试液遇酸变红色,所以D中产生白雾且试液变红色;溴离子和银离子反应生成淡黄色沉淀,看到的现象是生成淡黄色沉淀,
故答案为:有白雾,试液变红色;生成淡黄色沉淀;
(3)HBr极易溶于水而产生倒吸现象,互不相溶的液体混合时分层,水和苯、溴苯不互溶,所以看到的现象是液体倒吸,三口烧瓶中液体分层,
故答案为:液体倒吸,三口烧瓶中液体分层;
(4)挥发出的溴和生成的HBr都能和硝酸银反应生成淡黄色沉淀,所以该实验不能证明是取代反应,要证明发生了取代反应,应该先除去挥发的溴然后用硝酸银检验HBr,其改进方法为,
故答案为:发生反应时可能会有苯、溴等挥发出来,液溴溶于水后产生的Br-与AgNO3溶液反应生成浅黄色沉淀,所以不能证明反应是取代反应;可在装置A、C之间连接一个除杂的洗气瓶,内盛苯或四氯化碳等有机溶剂;
(5)三口烧瓶中的溴苯和未反应的溴、苯互溶,用水除去生成的HBr,用NaOH溶液除去
未反应的溴,用水除去溴化钠,然后干燥剂干燥除去水分,最后用蒸馏方法得到较纯净的溴苯,所以操作顺序是②④⑤③①,故选B.
点评 本题考查制备实验方案设计及实验评价,为高频考点,明确实验原理及物质性质是解本题关键,知道每个仪器的作用及可能发生的反应、产生的现象,难点是(4)题实验改进,侧重考查学生实验操作、实验评价能力,题目难点中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| B. | 标准状况下,14 g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4 L任意比的氢气和氯气的混气中含有分子总数均为NA | |
| D. | 在标准状况下,18gH2O所含有的电子数不是10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与碱反应生成盐和水 | B. | 使紫色石蕊试液变蓝色 | ||
| C. | 与活泼金属反应生成盐和氢气 | D. | 与氧化钠反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ,该反应的反应类型为加成反应
,该反应的反应类型为加成反应 
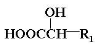 上的羟基可以氧化成羰基,再脱羧变成醛;
上的羟基可以氧化成羰基,再脱羧变成醛; (R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为
(R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为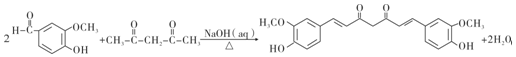
 可用于合成有机高分子色素,根据Claisen缩合反应,设计
可用于合成有机高分子色素,根据Claisen缩合反应,设计 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
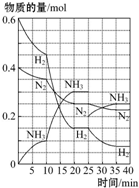 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A. | 反应开始到第一次平衡时,N2的平均反应速率为0.062 5 mol•L-1•min-1,H2的转化率为75% | |
| B. | 反应35 min时,达到第二次平衡时,反应的平衡常数:K=$\frac{0.1{5}^{2}}{0.07{5}^{3}•0.125}$ | |
| C. | 从曲线变化可以看出,反应进行到10~20 min时可能采取的措施是使用了催化剂 | |
| D. | 从曲线变化可以看出,反应进行至25 min时,采取的措施是分离出0.1 mol的氨气,平衡向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
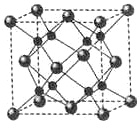 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | |||||||
| 3 | ① | ② | ④ | ⑤ | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com